The ten "diseases" that are not true diseases.
Depuydt PO, Kress JP, Salluh JI.
Intensive Care Med. 2016 Mar;42(3):411-4. PMID: 26130322
6.せん妄
以前は「混乱」「ICU精神病」「離脱状態」と呼ばれるか、もしくは見逃されてきたものをせん妄として認識し、その疫学やリスク因子、予後への影響が知られるに至った。ICUでのせん妄は独立した死亡のリスク因子であるが、ICUのせん妄は主にもともとその患者に存在する「脆弱性」を示しているだけのように思える。発生頻度はICUによってさまざまだが、これは定義や鎮静の仕方、患者背景の違いによる。ICUでのせん妄を予防するための知見が集まってはいるが、せん妄発症時に何をどこまでやればよいのかに関してはよくわかっていない。
7.急性腎不全/急性腎傷害
急性腎不全(ARF)の疫学や予後への影響、治療についての研究はその臨床的な定義の欠如が問題であった。また、ARFが腎疾患であるないしは腎におきる症候群であるという概念もおそらく間違いである。一方で、クレアチニン値の微細な変化が予後に大きな変化をもたらすことや、窒素性老廃物を除去し、水分バランスを是正し、電解質レベルを正常化させることが明らかな腎代替療法を要するICU患者の予後は依然として悪いことが分かっている。いかなる強度、方法、タイミングで行われた腎代替療法も予後を改善しない。ARFの概念はより広い領域をカバーし、様々な特徴を包括することができる急性腎傷害という概念にとってかわられた。
◎ 私見
特にせん妄については、前から似たようなことをずっと思っていた。せん妄をどう治療するのか、というところがその有用性とともに明らかにならないといずれ立ち枯れになる概念ではなかろうか。
2016年7月26日火曜日
2016年7月22日金曜日
ほんとうは病気ではない10の"疾患"②
The ten "diseases" that are not true diseases.
Depuydt PO, Kress JP, Salluh JI.
Intensive Care Med. 2016 Mar;42(3):411-4. PMID: 26130322
3.VAE
ICUの質の評価にVAPを用いる際にはその診断が主観的に行われる点が問題となる。そのため、より客観的で確実なVAEが新しい指標として提案された。しかし、VAEはVAPだけではなく様々な臨床状況を含んだ概念でである。VAEを積極的にモニタする前に、VAEが何を反映し、どのように予防するかについて考えておくべきである
4.Sick euthyroid illness
重症疾患が人体のホメオスタシスにどのように影響するのか真にわかってはいないままに、非重症患者の定義や概念を重症患者にあてはめている。このため、実際の病理学的変化とは別に単に数字のみで診断がなされている。Sick euthyroid illnessと診断された患者のホルモンレベルを正常化させても有効ではないばかりか有害である可能性が指摘されている。
5.相対的副腎不全
重症疾患では副腎機能が障害されることやコルチゾール欠乏に対して補充することが有用であることに疑いはないが、相対的副腎不全という疾患概念についてはまだはっきりとわかっていない。相対的副腎不全を診断する方法がなく、血漿コルチゾール濃度と予後との関係も複雑で、相対的副腎不全に対するホルモン補充も必ず予後を改善させるとは限らない。
◎ 私見
こうやって考えると、よくわからない曖昧模糊とした概念や決着のついていない事柄がICUでは飛び交っているのだなと思う。では集中治療医の存在はどうだろう。やっぱり曖昧な存在なのかな。
Depuydt PO, Kress JP, Salluh JI.
Intensive Care Med. 2016 Mar;42(3):411-4. PMID: 26130322
3.VAE
ICUの質の評価にVAPを用いる際にはその診断が主観的に行われる点が問題となる。そのため、より客観的で確実なVAEが新しい指標として提案された。しかし、VAEはVAPだけではなく様々な臨床状況を含んだ概念でである。VAEを積極的にモニタする前に、VAEが何を反映し、どのように予防するかについて考えておくべきである
4.Sick euthyroid illness
重症疾患が人体のホメオスタシスにどのように影響するのか真にわかってはいないままに、非重症患者の定義や概念を重症患者にあてはめている。このため、実際の病理学的変化とは別に単に数字のみで診断がなされている。Sick euthyroid illnessと診断された患者のホルモンレベルを正常化させても有効ではないばかりか有害である可能性が指摘されている。
5.相対的副腎不全
重症疾患では副腎機能が障害されることやコルチゾール欠乏に対して補充することが有用であることに疑いはないが、相対的副腎不全という疾患概念についてはまだはっきりとわかっていない。相対的副腎不全を診断する方法がなく、血漿コルチゾール濃度と予後との関係も複雑で、相対的副腎不全に対するホルモン補充も必ず予後を改善させるとは限らない。
◎ 私見
こうやって考えると、よくわからない曖昧模糊とした概念や決着のついていない事柄がICUでは飛び交っているのだなと思う。では集中治療医の存在はどうだろう。やっぱり曖昧な存在なのかな。
2016年7月17日日曜日
ほんとうは疾患ではない10の”疾患”①
The ten "diseases" that are not true diseases.
Depuydt PO, Kress JP, Salluh JI.
Intensive Care Med. 2016 Mar;42(3):411-4. PMID: 26130322
Depuydt PO, Kress JP, Salluh JI.
Intensive Care Med. 2016 Mar;42(3):411-4. PMID: 26130322
✔ イントロダクション
集中治療は比較的歴史の浅い専門分野である。医学の進歩により重篤な臓器不全があったとしても患者は長期間生命を維持できるようになったが、これはつまり、もともとの病態や病気の一般的な経過を超えて新しい領域に踏み込んでいることに他ならない。この領域を探索することで、どのように医学を発展させることができるかを要約できる。まず、疾患と症候群という概念を用いて生理学的現象の複雑性を説明する。原因を特定することで予防や決定的治療を行うことができ、経過を明らかにすることで病態の進行を逆転させたり軽減することができる。しかし、現実は我々の提唱する概念よりも複雑で予想不可能なものである。疾患が思考の産物であったり過度の単純化の結果であったりするし、症候群がただの袋であることもある。このような場合、治療を誤りがちである。
1.ARDS
近年発表された新しい基準においても、ARDSの臨床診断はその病理組織とほとんど相関しない。ARDSを診断することは、医原性の肺障害を防ぐ筋弛緩薬や腹臥位のような治療を選択する根拠となるため重要であるが、薬物学的治療に対する反応を正確に予測することはできない。例えば”改善しないARDS”といった場合、BOOPや亜急性過敏性肺臓炎のようなステロイドが効果のある病態であることもあるし、肺線維症のようにステロイドが無効の病態もある。
2.VAPとVAT
VAPには診断のゴールドスタンダードがなく、定義もとらえどころがない。臨床的・放射線学的診断は不正確で、多くの非感染症を含み、不要な抗菌薬投与の原因となってしまっている。細菌学的な厳しい基準を用いれば特異度はあがるが、感度が低下してしまって必要な抗菌薬投与を行えなくなってしまう可能性がある。VAPを明確な診断と考えるのではなく、抗菌薬投与の指標となる相対的なものととらえるべきである。VATは肺浸潤影のないVAPである。肺浸潤影に対するポータブルX線写真の感度や観察者間の差を考えるとVATとVAPはオーバラップしていると考えられる。現時点ではVATにどのようにアプローチすべきかわかっていない。早期の抗菌薬投与がVATのアウトカムを変えるかどうか明らかにされておらず、予防的なアプローチによってVAPやVATを減らすことができても最終的な転帰は変わらないことが知られている。
◎ 私見
例えばARDSを診断しても、それが患者さんの運命を変えることができなければ意味がない。回診の際に飛び交うこれらの「診断名」にどんな意味があるのかを考えるべき、ということだろう。
◎ 私見
例えばARDSを診断しても、それが患者さんの運命を変えることができなければ意味がない。回診の際に飛び交うこれらの「診断名」にどんな意味があるのかを考えるべき、ということだろう。
2016年7月14日木曜日
ケタミンによる鎮痛鎮静③
Ketamine for Analgosedation in the Intensive Care Unit: A Systematic Review.
Patanwala AE, Martin JR, Erstad BL.
J Intensive Care Med. 2015 Dec 8. PMID: 26647407
✔ ICUにおけるケタミン(臨床研究)
ICUにおいてケタミンを少なくとも24時間連続投与して従来の薬剤の効果と比較した臨床研究は六つある。Guillouらのモルヒネ投与量減少効果を報告した93例を対象とした研究を除くと、各々の研究は30例を超えることのない小規模な研究ではあるが、消化管機能や脳血管系、心臓血管系への影響を調査している。サンプルサイズが小さいという問題はあるが、これらの研究によると、重症頭部外傷に対して脳血管系には有意な副作用はなく、高用量投与においてわずかに(1~2㎜Hg)頭蓋内圧を上げるが同時に脳灌流圧も高くなっていた。全身の血行動態に対しては一部の患者では有用(低血圧に対する血管作動薬の投与量を減らせた)であるが、ケタミンの用量や心血管系疾患の既往によっては有害(心不全や心筋虚血を悪化させる)であった。他の非無作為化試験の結果もこれらの研究の結果とほぼ同様であった。
✔ ケタミンによる鎮痛鎮静の実際
ケタミン使用の実際を示す(表)。これは重篤な疼痛を訴える患者に対して第一選択と考えられる従来の鎮痛薬(NSAIDSやオピオイド)をしっかりと使用したことを前提として設定されている投与計画である。従来の方法に対して反応が悪い場合にケタミンの使用を考えるが、反応が悪いということを明確に定義するものはない。おおむね最大投与量を使用しても疼痛があったり副作用が問題となる場合にケタミンの併用を考える。
過去の研究に示された投与計画は様々であるが、古い時代の研究は人工呼吸管理開始とともに中断することなく麻酔状態を達成するために鎮静薬が投与されていたことを考慮しなくてはならない。ここに記載してあるのはかなり姑息的な投与量としてあり、精神症状のような副作用でせん妄や他の中枢神経症状との鑑別に難渋しないようにすることを目標としている。ケタミンを長期間投与すると薬剤が蓄積し、回復に時間がかかる。そこで、ケタミンを持続投与する場合は毎日中断してSATすることを推奨する。他の方法としては1-time 4-hour法というものがあり、これは様々な癌性疼痛/非癌性疼痛に対して数日にわたる痛みを減らすために用いられる方法である。急激な疼痛に対してはボーラス投与が必要であり、0.2~0.5㎎/kgという投与量を推奨している。しかし、高用量では健常人でも意識消失する可能性があるため、下限の0.2㎎/kgから始めるほうが良い。処置時の鎮静のように意識消失が必要である場合は1㎎/kgくらいの高用量が必要である。用量調節を柔軟に行うため、他の薬剤との混注は推奨しない。
◎ 私見
0.06mg/kg/hrで開始して最大1.2㎎/kg/hrまで増量可能。体重50㎏の人なら1時間あたり3㎎で開始して最大60㎎。熱傷患者とか若い多発外傷患者とか良いのかなと思ってはいるがこういった患者さんは痛みのためにDaily interuptionもしづらいし、長期投与にもなりがちだから悩ましいところ。
Patanwala AE, Martin JR, Erstad BL.
J Intensive Care Med. 2015 Dec 8. PMID: 26647407
✔ ICUにおけるケタミン(臨床研究)
ICUにおいてケタミンを少なくとも24時間連続投与して従来の薬剤の効果と比較した臨床研究は六つある。Guillouらのモルヒネ投与量減少効果を報告した93例を対象とした研究を除くと、各々の研究は30例を超えることのない小規模な研究ではあるが、消化管機能や脳血管系、心臓血管系への影響を調査している。サンプルサイズが小さいという問題はあるが、これらの研究によると、重症頭部外傷に対して脳血管系には有意な副作用はなく、高用量投与においてわずかに(1~2㎜Hg)頭蓋内圧を上げるが同時に脳灌流圧も高くなっていた。全身の血行動態に対しては一部の患者では有用(低血圧に対する血管作動薬の投与量を減らせた)であるが、ケタミンの用量や心血管系疾患の既往によっては有害(心不全や心筋虚血を悪化させる)であった。他の非無作為化試験の結果もこれらの研究の結果とほぼ同様であった。
✔ ケタミンによる鎮痛鎮静の実際
ケタミン使用の実際を示す(表)。これは重篤な疼痛を訴える患者に対して第一選択と考えられる従来の鎮痛薬(NSAIDSやオピオイド)をしっかりと使用したことを前提として設定されている投与計画である。従来の方法に対して反応が悪い場合にケタミンの使用を考えるが、反応が悪いということを明確に定義するものはない。おおむね最大投与量を使用しても疼痛があったり副作用が問題となる場合にケタミンの併用を考える。
過去の研究に示された投与計画は様々であるが、古い時代の研究は人工呼吸管理開始とともに中断することなく麻酔状態を達成するために鎮静薬が投与されていたことを考慮しなくてはならない。ここに記載してあるのはかなり姑息的な投与量としてあり、精神症状のような副作用でせん妄や他の中枢神経症状との鑑別に難渋しないようにすることを目標としている。ケタミンを長期間投与すると薬剤が蓄積し、回復に時間がかかる。そこで、ケタミンを持続投与する場合は毎日中断してSATすることを推奨する。他の方法としては1-time 4-hour法というものがあり、これは様々な癌性疼痛/非癌性疼痛に対して数日にわたる痛みを減らすために用いられる方法である。急激な疼痛に対してはボーラス投与が必要であり、0.2~0.5㎎/kgという投与量を推奨している。しかし、高用量では健常人でも意識消失する可能性があるため、下限の0.2㎎/kgから始めるほうが良い。処置時の鎮静のように意識消失が必要である場合は1㎎/kgくらいの高用量が必要である。用量調節を柔軟に行うため、他の薬剤との混注は推奨しない。
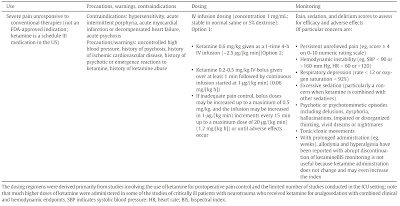 |
| ケタミン投与法(文献より引用) |
0.06mg/kg/hrで開始して最大1.2㎎/kg/hrまで増量可能。体重50㎏の人なら1時間あたり3㎎で開始して最大60㎎。熱傷患者とか若い多発外傷患者とか良いのかなと思ってはいるがこういった患者さんは痛みのためにDaily interuptionもしづらいし、長期投与にもなりがちだから悩ましいところ。
2016年7月11日月曜日
ケタミンによる鎮痛鎮静②
Ketamine for Analgosedation in the Intensive Care Unit: A Systematic Review.
Patanwala AE, Martin JR, Erstad BL.
J Intensive Care Med. 2015 Dec 8. PMID: 26647407
✔ 副作用
ケタミンはその特異な薬理作用のため、副作用についても他の鎮痛薬とは全く異なっている。例えばNSAIDSのような消化管や腎への悪影響がない。またオピオイドと異なりµ受容体に作用しないため消化管運動障害がない。また、咽頭や喉頭の防御的反射機能に影響せず、気道抵抗を低減し、肺コンプライアンスを高め、呼吸抑制を起こすこともない(大量急速投与しなければ)。このような呼吸器系への有用な作用のため、喘息重責発作の人工呼吸管理のような状況における有用性が示唆される。気道内にかかる圧が高くなることにより(訳者註:圧がかかりやすくなる、という意味か?)肺高血圧を悪化させる可能性があるため、そのような状況では注意が必要である。要約すると、オピオイドのような他の鎮痛薬と異なりケタミンは消化管や呼吸器系に重篤な副作用を起こしづらく、重症患者においても十分に従来の鎮痛薬の代替となりうると言える。
中枢神経系に関しては、オピオイドが全般的に抑制を起こすのとは対照的にケタミンは興奮と抑制の両者を引き起こす。このため、ケタミンは痙攣を誘発すると考えられており、実際痙攣が誘発されたとする症例報告がある。しかし、もともと転換の既往のある患者を対象とした研究では、痙攣を誘発することなくむしろ痙攣脳波を抑制したと報告している。初期の研究で報告された痙攣誘発については、モニタが適切ではなかった、脳波記録と中枢神経興奮に関する誤った結論、他の誘因の存在、ケタミン投与に伴う骨格筋痙攣をてんかん発作と誤認した、などの解釈がなされている。近年の報告ではてんかん重積に有用であったとするものもあるが、エビデンスが欠けておりガイドラインにおいても最終手段として紹介されているに過ぎない。以上より、頭部外傷のような痙攣のリスクの高い患者においても、ICUで短期間使用するのであれば特に問題はないであろうと考えられる。
ケタミンは精神作用があることがよく知られている。約30%の成人において、覚醒時に幻覚や精神病様の症状のような”覚醒時反応”が認められた。投与量と精神作用には関連がなく、徐々に投与量を変化させることで精神作用を減じることができたとする報告がある。低用量(1㎎/kg緩徐投与)、低血漿濃度(<100ng/ml)でも統合失調症様ないし解離症状が出現しうる。この点から、重症患者ではせん妄の原因となって予後を悪化させるのではないかと考えられてきた。例えば、近年のシステマチックレビューで、せん妄を起こした重症患者はそうではない患者と比べて死亡のリスクが高くICU在室日数や在院日数が長くなることが示されている。この精神作用に対し、それ自体もせん妄の原因とはなりうるが、ベンゾジアゼピンが予防のために用いられている。ベンゾジアゼピンはP450系を介してケタミンと相互作用し、その作用を延長する。一般に精神症状や離脱症候群を起こしたことがある患者ではケタミンは避けたほうが良い。ケタミンを鎮痛鎮静に用いるのであれば徐々に投与量を増減し、精神症状について注意深くモニタすることを推奨する。
ケタミンの心血管系に対する作用は他の鎮静薬とは全く異なっており、注目に値する。ケタミンは交感神経系刺激作用があり、アドレナリンの作用を増強するが、これによって心筋に対する直接的な収縮抑制作用が拮抗される。また、再取り込みを抑制することで全身のカテコラミン濃度を増加させる。心拍数や血圧は上昇するため、他の鎮静薬とは全く反対の作用をもたらすことになる。これは健常者で認められる効果であるが、カテコラミンが減っている万世紀にある重症患者でも同様の効果があるかどうかはわからない。一つの研究ではあるが、重症患者ではケタミンで血圧が低下することが報告されている。ケタミンにより頭蓋内圧が上昇する可能性があるが、システマチックレビューではこのような現象の証拠は示されなかった。ケタミンは投与量を調整すれば血行動態が不安定な重症患者でも安全であるが、虚血性心疾患がある患者では避けたほうがよいだろう。
◎ 私見
このあたりの記述は麻酔科医ならほぼ常識かな。頭蓋内圧や痙攣誘発、重症患者の血行動態に与える影響などのニュアンスについても同様。こういう癖のある薬を協働する他の科の医師やパラメディカルの方々に合わせて調整していけるかどうかが実は大変なのではないかと思ったりする。
Patanwala AE, Martin JR, Erstad BL.
J Intensive Care Med. 2015 Dec 8. PMID: 26647407
✔ 副作用
ケタミンはその特異な薬理作用のため、副作用についても他の鎮痛薬とは全く異なっている。例えばNSAIDSのような消化管や腎への悪影響がない。またオピオイドと異なりµ受容体に作用しないため消化管運動障害がない。また、咽頭や喉頭の防御的反射機能に影響せず、気道抵抗を低減し、肺コンプライアンスを高め、呼吸抑制を起こすこともない(大量急速投与しなければ)。このような呼吸器系への有用な作用のため、喘息重責発作の人工呼吸管理のような状況における有用性が示唆される。気道内にかかる圧が高くなることにより(訳者註:圧がかかりやすくなる、という意味か?)肺高血圧を悪化させる可能性があるため、そのような状況では注意が必要である。要約すると、オピオイドのような他の鎮痛薬と異なりケタミンは消化管や呼吸器系に重篤な副作用を起こしづらく、重症患者においても十分に従来の鎮痛薬の代替となりうると言える。
中枢神経系に関しては、オピオイドが全般的に抑制を起こすのとは対照的にケタミンは興奮と抑制の両者を引き起こす。このため、ケタミンは痙攣を誘発すると考えられており、実際痙攣が誘発されたとする症例報告がある。しかし、もともと転換の既往のある患者を対象とした研究では、痙攣を誘発することなくむしろ痙攣脳波を抑制したと報告している。初期の研究で報告された痙攣誘発については、モニタが適切ではなかった、脳波記録と中枢神経興奮に関する誤った結論、他の誘因の存在、ケタミン投与に伴う骨格筋痙攣をてんかん発作と誤認した、などの解釈がなされている。近年の報告ではてんかん重積に有用であったとするものもあるが、エビデンスが欠けておりガイドラインにおいても最終手段として紹介されているに過ぎない。以上より、頭部外傷のような痙攣のリスクの高い患者においても、ICUで短期間使用するのであれば特に問題はないであろうと考えられる。
ケタミンは精神作用があることがよく知られている。約30%の成人において、覚醒時に幻覚や精神病様の症状のような”覚醒時反応”が認められた。投与量と精神作用には関連がなく、徐々に投与量を変化させることで精神作用を減じることができたとする報告がある。低用量(1㎎/kg緩徐投与)、低血漿濃度(<100ng/ml)でも統合失調症様ないし解離症状が出現しうる。この点から、重症患者ではせん妄の原因となって予後を悪化させるのではないかと考えられてきた。例えば、近年のシステマチックレビューで、せん妄を起こした重症患者はそうではない患者と比べて死亡のリスクが高くICU在室日数や在院日数が長くなることが示されている。この精神作用に対し、それ自体もせん妄の原因とはなりうるが、ベンゾジアゼピンが予防のために用いられている。ベンゾジアゼピンはP450系を介してケタミンと相互作用し、その作用を延長する。一般に精神症状や離脱症候群を起こしたことがある患者ではケタミンは避けたほうが良い。ケタミンを鎮痛鎮静に用いるのであれば徐々に投与量を増減し、精神症状について注意深くモニタすることを推奨する。
ケタミンの心血管系に対する作用は他の鎮静薬とは全く異なっており、注目に値する。ケタミンは交感神経系刺激作用があり、アドレナリンの作用を増強するが、これによって心筋に対する直接的な収縮抑制作用が拮抗される。また、再取り込みを抑制することで全身のカテコラミン濃度を増加させる。心拍数や血圧は上昇するため、他の鎮静薬とは全く反対の作用をもたらすことになる。これは健常者で認められる効果であるが、カテコラミンが減っている万世紀にある重症患者でも同様の効果があるかどうかはわからない。一つの研究ではあるが、重症患者ではケタミンで血圧が低下することが報告されている。ケタミンにより頭蓋内圧が上昇する可能性があるが、システマチックレビューではこのような現象の証拠は示されなかった。ケタミンは投与量を調整すれば血行動態が不安定な重症患者でも安全であるが、虚血性心疾患がある患者では避けたほうがよいだろう。
 |
| ケタミンの薬理作用(文献より引用) |
このあたりの記述は麻酔科医ならほぼ常識かな。頭蓋内圧や痙攣誘発、重症患者の血行動態に与える影響などのニュアンスについても同様。こういう癖のある薬を協働する他の科の医師やパラメディカルの方々に合わせて調整していけるかどうかが実は大変なのではないかと思ったりする。
2016年7月8日金曜日
ケタミンによる鎮痛鎮静①
Ketamine for Analgosedation in the Intensive Care Unit: A Systematic Review.
Patanwala AE, Martin JR, Erstad BL.
J Intensive Care Med. 2015 Dec 8. PMID: 26647407
Patanwala AE, Martin JR, Erstad BL.
J Intensive Care Med. 2015 Dec 8. PMID: 26647407
✔ イントロダクション
ケタミンは1962年に合成され、1964年に臨床試験された。当初、解離性麻酔薬として使用されていたが時を置かずに鎮痛薬として使用されるようになった。術後の慢性疼痛やCRPSといった非重症患者を対象とする臨床試験が数多く施行された。オピオイドは鎮痛鎮静薬の基本だが重症患者に応用する際には副作用が問題となる。ケタミンは低用量では特異な鎮痛鎮静作用を持ち、高用量では麻酔薬として作用するが、ICUにおける有用性を検討した研究はほとんどない。
近年発表されたPADガイドラインではエビデンスの欠如が指摘されており、わずかに神経因性疼痛に対する非オピオイド性鎮痛薬の一種としてのみ触れらている程度である。現在のところ、ICU患者に対するケタミンの持続投与の効果を検証したシステマチックレビューはひとつのみである。
エビデンスが欠けているにもかかわらずケタミンはICUで使用されているが、有効な症例や用量、モニタ法についてはわかっていない。このレビューは成人重症患者にケタミンをしようとするときに有用なガイドとなることを目的としている。
✔ 薬力学・薬理作用
他の薬剤と同様、個々の症例において分布容積やクリアランスはかなり異なる。さらにこのばらつきは重症患者でより大きくなる。このことから、特に肥満患者で持続的に投与することで脂肪組織に蓄積し、再分布によって作用が遷延するのではないかと考えられる。血漿中でアルブミンやα1棟蛋白と結合するケタミンは50%未満であり、臨床的に有意な蛋白結合による作用の変化はないと考えられる。米国においてケタミンはラセミ体で提供されているが、より鎮痛作用の強いS体の製剤が他国では売られている。ケタミンはP450系で代謝されて約3分の1の活性のあるノルケタミンとなるが、特定のミクソームの酵素や代謝部位、薬物ー酵素連関、薬物相互作用についてはまだ明らかになっていない。
ケタミンの薬理作用はNMDA受容体を遮断することによってもたらされるが、用量や濃度によってはオピオイド受容体遮断作用やGABA抑制、中枢神経や末梢組織における神経伝達を修飾するような作用もある。濃度依存性の鎮痛作用や麻酔作用が示されているが、TDMが行えるような体制とはなっていない。
 |
| ケタミンの薬理(文献より引用) |
◎ 私見
ケタミンはICUではほとんど使ったことがなく、もっぱら救急外来における処置時の鎮痛鎮静に用いていた。オピオイドなどの手段による鎮痛に限界を感じる症例が数例あり、新しいアプローチを模索している最中であったのでこのショートレビューを読んだ。大学院生の時に神経保護の観点からケタミンを勉強したことがあり、自分にとってはなんとなく身近に感じる薬で使うことに抵抗はないのだけど、他の先生方はどうなのだろう?
2016年7月5日火曜日
ハロペリドール無効のせん妄にデクスメデトミジンは有効
Dexmedetomidine for the Treatment of Hyperactive Delirium Refractory to Haloperidol in Nonintubated ICU Patients: A Nonrandomized Controlled Trial.
Carrasco G, Baeza N, Cabré L, Portillo E, Gimeno G, Manzanedo D, Calizaya M.
Crit Care Med. 2016 Jul;44(7):1295-306. PMID: 26925523
Carrasco G, Baeza N, Cabré L, Portillo E, Gimeno G, Manzanedo D, Calizaya M.
Crit Care Med. 2016 Jul;44(7):1295-306. PMID: 26925523
✔ 背景
せん妄はICU合併症として頻度が高い。国際的なガイドラインではハロペリドールがせん妄に対して推奨されているが、ハロペリドールが禁忌の症例や高用量でも無効な場合にどのような選択肢があるのかは示されていない。そこで、活発型のせん妄を呈する非挿管患者に対してデクスメデトミジンを用いることの有用性について検討した。
✔ 方法
非無作為化比較対照試験。Medical-Surgical ICUに入室した連続する活発型せん妄患者を対象とした。全症例はまずハロペリドールをRASS 0~-2になるか一日の最大投与量に達するまで投与した。次いで、ハロペリドールが有用であった群を対照とし、無効であった群にデクスメデトミジン(DEX)を投与した。
・ハロペリドール投与法
初期鎮静:2.5~5㎎を10~30分おきに投与。1日の最大量は30㎎に設定した
維持鎮静:ハロペリドールが有効であった場合、0.5~1㎎/hrで持続投与した
・DEX投与方法
ハロペリドールによる初期鎮静無効例に対して上記のハロペリドール維持鎮静に加えてDEXを0.2µg/kg/hrで持続投与した(ボーラスはしない)。さらにRASS 0を達成するために0.7µg/kg/hrまで増量した。ハロペリドールは漸減した。
✔ 結果
132例が対象となった。46例(34.8%)はハロペリドールが無効であり、残りの86例(65.2%)は有効であった。DEXを投与すると、大部分の患者に対して安全で良好な鎮静レベルを達成できた(92.7%)。ハロペリドールは過鎮静(11.6%)やQT延長(2.0%)の原因となった。DEXはハロペリドールより高コスト(17倍)であるが、ICU在室日数を減らすため、最終的には4370ドルの経費節減となった。
✔ 結論
DEXはハロペリドールが無効である非挿管患者の活発型せん妄に対し、安全かつ有効であり、コストも安い。
◎ 私見
ハロペリドールが有効であった群と無効であった群で比較しているという点に注意が必要だが、それを差し引いてもDEXは良さそうである。それにしてもハロペリドール有効群の1日投与量の平均が40㎎近い。5㎎のアンプルを1日8本使う計算である。日本でもこのような使い方をしている施設ってあるのだろうか?(当施設はこの量の半分以下しか使われていない)
2016年7月2日土曜日
ICUにおける身体診察②
Bedside Diagnosis in the Intensive Care Unit. Is Looking Overlooked?
Metkus TS, Kim BS.
Ann Am Thorac Soc. 2015 Oct;12(10):1447-50. PMID: 26389653
Metkus TS, Kim BS.
Ann Am Thorac Soc. 2015 Oct;12(10):1447-50. PMID: 26389653
✔ 身体診察の実状
エビデンスの欠けた状況では、施設が違えば身体診察に関する態度も変わってくるだろう。また、体位変換、不安定性、ドレッシング、点滴ライン、チューブ、モニタコード、騒音などの身体診察を難しくする要素がICUには存在する。
ICUにおける身体診察は系統的なアプローチがよいと思われるが、その実際についてはほとんどデータがない。ある調査では、研修医や医学生、看護師は患者診察を行うが、指導医は時々診察するか全くしないという状況であった。
あるICUではすべての患者に対して医師、看護師、学生からなるチームが回診時に診察を行っていた。一方で他のICUでは研修医が回診前に予診を行い回診時に報告するも、上級医はその所見を確認していなかった。
電子カルテに記載された診察所見が記述者自身が確認した所見のみで構成されることはほとんどないということも考えなくてはならない。2006年の調査では、25%の記述はコピーペーストされたものであった。最近のものはもっと悪くなっており、4分の3の医師が作成した記述のなかに20%以上のコピーペーストが認められている。
医師は回診前、回診後、回診中に診察するか、もしくは全くしない。新しい重症患者が入室するとチームはそちらにかかりきりになり、ほかの患者の診察は後回しになる。感染予防のために隔離処置されていたり、検査中ないし手技中の場合も同様である。実際、ある調査では医師は通常の患者の73%を診察するが(これも低い数字ではあるが)、隔離中では35%に減少することが示されている。ICUにおける標準的ない身体診察というものは存在しないし、どれが有用かもわかっておらず、診察チームに誰が含まれるべきかもわかっていないのである。
✔ 我々の方法
系統的な身体診察はそれなりに価値があると考えている。ベッドサイドでの評価には身体診察だけでなく、カテーテルや医療機器、術創部、モニタの数字、呼吸器の波形モニタなどの評価も含まれ、家族の様子なども評価対象となる。
評価はチェックリストを用いて行う。多職種チームで診察をすることで教育や学習効果も期待できる。診断は、それ単独では誤診につながるといわれる画像や血行動態モニタを適切に参照して行う。このようなアプローチには時間がかかるが、家族はICUでのケアに満足する。ベッドサイドでの”手当て”はハイテク機器や高度な治療のために非人間化されがちなICUにおいて、人間らしさをもたらす。
◎ 私見
以下、超音波検査を組み込むこと、系統的身体診察の有用性を検討するためのRCTが望まれることが述べられている。
「ICU患者の評価」をどのように行うのが良いのか、ここのところずっと気になっている。他の施設の他の先生方はどうしているのだろう? 何から始めて、どれくらい時間をかけて、カルテにどのように記載するのか。JSEPTICのアンケートでやらないかな・・・
ICUにおける身体診察は系統的なアプローチがよいと思われるが、その実際についてはほとんどデータがない。ある調査では、研修医や医学生、看護師は患者診察を行うが、指導医は時々診察するか全くしないという状況であった。
あるICUではすべての患者に対して医師、看護師、学生からなるチームが回診時に診察を行っていた。一方で他のICUでは研修医が回診前に予診を行い回診時に報告するも、上級医はその所見を確認していなかった。
電子カルテに記載された診察所見が記述者自身が確認した所見のみで構成されることはほとんどないということも考えなくてはならない。2006年の調査では、25%の記述はコピーペーストされたものであった。最近のものはもっと悪くなっており、4分の3の医師が作成した記述のなかに20%以上のコピーペーストが認められている。
医師は回診前、回診後、回診中に診察するか、もしくは全くしない。新しい重症患者が入室するとチームはそちらにかかりきりになり、ほかの患者の診察は後回しになる。感染予防のために隔離処置されていたり、検査中ないし手技中の場合も同様である。実際、ある調査では医師は通常の患者の73%を診察するが(これも低い数字ではあるが)、隔離中では35%に減少することが示されている。ICUにおける標準的ない身体診察というものは存在しないし、どれが有用かもわかっておらず、診察チームに誰が含まれるべきかもわかっていないのである。
✔ 我々の方法
系統的な身体診察はそれなりに価値があると考えている。ベッドサイドでの評価には身体診察だけでなく、カテーテルや医療機器、術創部、モニタの数字、呼吸器の波形モニタなどの評価も含まれ、家族の様子なども評価対象となる。
評価はチェックリストを用いて行う。多職種チームで診察をすることで教育や学習効果も期待できる。診断は、それ単独では誤診につながるといわれる画像や血行動態モニタを適切に参照して行う。このようなアプローチには時間がかかるが、家族はICUでのケアに満足する。ベッドサイドでの”手当て”はハイテク機器や高度な治療のために非人間化されがちなICUにおいて、人間らしさをもたらす。
 |
| 系統的診察(文献より引用) |
以下、超音波検査を組み込むこと、系統的身体診察の有用性を検討するためのRCTが望まれることが述べられている。
「ICU患者の評価」をどのように行うのが良いのか、ここのところずっと気になっている。他の施設の他の先生方はどうしているのだろう? 何から始めて、どれくらい時間をかけて、カルテにどのように記載するのか。JSEPTICのアンケートでやらないかな・・・
登録:
コメント (Atom)