The ten "diseases" that are not true diseases.
Depuydt PO, Kress JP, Salluh JI.
Intensive Care Med. 2016 Mar;42(3):411-4. PMID: 26130322
6.せん妄
以前は「混乱」「ICU精神病」「離脱状態」と呼ばれるか、もしくは見逃されてきたものをせん妄として認識し、その疫学やリスク因子、予後への影響が知られるに至った。ICUでのせん妄は独立した死亡のリスク因子であるが、ICUのせん妄は主にもともとその患者に存在する「脆弱性」を示しているだけのように思える。発生頻度はICUによってさまざまだが、これは定義や鎮静の仕方、患者背景の違いによる。ICUでのせん妄を予防するための知見が集まってはいるが、せん妄発症時に何をどこまでやればよいのかに関してはよくわかっていない。
7.急性腎不全/急性腎傷害
急性腎不全(ARF)の疫学や予後への影響、治療についての研究はその臨床的な定義の欠如が問題であった。また、ARFが腎疾患であるないしは腎におきる症候群であるという概念もおそらく間違いである。一方で、クレアチニン値の微細な変化が予後に大きな変化をもたらすことや、窒素性老廃物を除去し、水分バランスを是正し、電解質レベルを正常化させることが明らかな腎代替療法を要するICU患者の予後は依然として悪いことが分かっている。いかなる強度、方法、タイミングで行われた腎代替療法も予後を改善しない。ARFの概念はより広い領域をカバーし、様々な特徴を包括することができる急性腎傷害という概念にとってかわられた。
◎ 私見
特にせん妄については、前から似たようなことをずっと思っていた。せん妄をどう治療するのか、というところがその有用性とともに明らかにならないといずれ立ち枯れになる概念ではなかろうか。
2016年7月26日火曜日
2016年7月22日金曜日
ほんとうは病気ではない10の"疾患"②
The ten "diseases" that are not true diseases.
Depuydt PO, Kress JP, Salluh JI.
Intensive Care Med. 2016 Mar;42(3):411-4. PMID: 26130322
3.VAE
ICUの質の評価にVAPを用いる際にはその診断が主観的に行われる点が問題となる。そのため、より客観的で確実なVAEが新しい指標として提案された。しかし、VAEはVAPだけではなく様々な臨床状況を含んだ概念でである。VAEを積極的にモニタする前に、VAEが何を反映し、どのように予防するかについて考えておくべきである
4.Sick euthyroid illness
重症疾患が人体のホメオスタシスにどのように影響するのか真にわかってはいないままに、非重症患者の定義や概念を重症患者にあてはめている。このため、実際の病理学的変化とは別に単に数字のみで診断がなされている。Sick euthyroid illnessと診断された患者のホルモンレベルを正常化させても有効ではないばかりか有害である可能性が指摘されている。
5.相対的副腎不全
重症疾患では副腎機能が障害されることやコルチゾール欠乏に対して補充することが有用であることに疑いはないが、相対的副腎不全という疾患概念についてはまだはっきりとわかっていない。相対的副腎不全を診断する方法がなく、血漿コルチゾール濃度と予後との関係も複雑で、相対的副腎不全に対するホルモン補充も必ず予後を改善させるとは限らない。
◎ 私見
こうやって考えると、よくわからない曖昧模糊とした概念や決着のついていない事柄がICUでは飛び交っているのだなと思う。では集中治療医の存在はどうだろう。やっぱり曖昧な存在なのかな。
Depuydt PO, Kress JP, Salluh JI.
Intensive Care Med. 2016 Mar;42(3):411-4. PMID: 26130322
3.VAE
ICUの質の評価にVAPを用いる際にはその診断が主観的に行われる点が問題となる。そのため、より客観的で確実なVAEが新しい指標として提案された。しかし、VAEはVAPだけではなく様々な臨床状況を含んだ概念でである。VAEを積極的にモニタする前に、VAEが何を反映し、どのように予防するかについて考えておくべきである
4.Sick euthyroid illness
重症疾患が人体のホメオスタシスにどのように影響するのか真にわかってはいないままに、非重症患者の定義や概念を重症患者にあてはめている。このため、実際の病理学的変化とは別に単に数字のみで診断がなされている。Sick euthyroid illnessと診断された患者のホルモンレベルを正常化させても有効ではないばかりか有害である可能性が指摘されている。
5.相対的副腎不全
重症疾患では副腎機能が障害されることやコルチゾール欠乏に対して補充することが有用であることに疑いはないが、相対的副腎不全という疾患概念についてはまだはっきりとわかっていない。相対的副腎不全を診断する方法がなく、血漿コルチゾール濃度と予後との関係も複雑で、相対的副腎不全に対するホルモン補充も必ず予後を改善させるとは限らない。
◎ 私見
こうやって考えると、よくわからない曖昧模糊とした概念や決着のついていない事柄がICUでは飛び交っているのだなと思う。では集中治療医の存在はどうだろう。やっぱり曖昧な存在なのかな。
2016年7月17日日曜日
ほんとうは疾患ではない10の”疾患”①
The ten "diseases" that are not true diseases.
Depuydt PO, Kress JP, Salluh JI.
Intensive Care Med. 2016 Mar;42(3):411-4. PMID: 26130322
Depuydt PO, Kress JP, Salluh JI.
Intensive Care Med. 2016 Mar;42(3):411-4. PMID: 26130322
✔ イントロダクション
集中治療は比較的歴史の浅い専門分野である。医学の進歩により重篤な臓器不全があったとしても患者は長期間生命を維持できるようになったが、これはつまり、もともとの病態や病気の一般的な経過を超えて新しい領域に踏み込んでいることに他ならない。この領域を探索することで、どのように医学を発展させることができるかを要約できる。まず、疾患と症候群という概念を用いて生理学的現象の複雑性を説明する。原因を特定することで予防や決定的治療を行うことができ、経過を明らかにすることで病態の進行を逆転させたり軽減することができる。しかし、現実は我々の提唱する概念よりも複雑で予想不可能なものである。疾患が思考の産物であったり過度の単純化の結果であったりするし、症候群がただの袋であることもある。このような場合、治療を誤りがちである。
1.ARDS
近年発表された新しい基準においても、ARDSの臨床診断はその病理組織とほとんど相関しない。ARDSを診断することは、医原性の肺障害を防ぐ筋弛緩薬や腹臥位のような治療を選択する根拠となるため重要であるが、薬物学的治療に対する反応を正確に予測することはできない。例えば”改善しないARDS”といった場合、BOOPや亜急性過敏性肺臓炎のようなステロイドが効果のある病態であることもあるし、肺線維症のようにステロイドが無効の病態もある。
2.VAPとVAT
VAPには診断のゴールドスタンダードがなく、定義もとらえどころがない。臨床的・放射線学的診断は不正確で、多くの非感染症を含み、不要な抗菌薬投与の原因となってしまっている。細菌学的な厳しい基準を用いれば特異度はあがるが、感度が低下してしまって必要な抗菌薬投与を行えなくなってしまう可能性がある。VAPを明確な診断と考えるのではなく、抗菌薬投与の指標となる相対的なものととらえるべきである。VATは肺浸潤影のないVAPである。肺浸潤影に対するポータブルX線写真の感度や観察者間の差を考えるとVATとVAPはオーバラップしていると考えられる。現時点ではVATにどのようにアプローチすべきかわかっていない。早期の抗菌薬投与がVATのアウトカムを変えるかどうか明らかにされておらず、予防的なアプローチによってVAPやVATを減らすことができても最終的な転帰は変わらないことが知られている。
◎ 私見
例えばARDSを診断しても、それが患者さんの運命を変えることができなければ意味がない。回診の際に飛び交うこれらの「診断名」にどんな意味があるのかを考えるべき、ということだろう。
◎ 私見
例えばARDSを診断しても、それが患者さんの運命を変えることができなければ意味がない。回診の際に飛び交うこれらの「診断名」にどんな意味があるのかを考えるべき、ということだろう。
2016年7月14日木曜日
ケタミンによる鎮痛鎮静③
Ketamine for Analgosedation in the Intensive Care Unit: A Systematic Review.
Patanwala AE, Martin JR, Erstad BL.
J Intensive Care Med. 2015 Dec 8. PMID: 26647407
✔ ICUにおけるケタミン(臨床研究)
ICUにおいてケタミンを少なくとも24時間連続投与して従来の薬剤の効果と比較した臨床研究は六つある。Guillouらのモルヒネ投与量減少効果を報告した93例を対象とした研究を除くと、各々の研究は30例を超えることのない小規模な研究ではあるが、消化管機能や脳血管系、心臓血管系への影響を調査している。サンプルサイズが小さいという問題はあるが、これらの研究によると、重症頭部外傷に対して脳血管系には有意な副作用はなく、高用量投与においてわずかに(1~2㎜Hg)頭蓋内圧を上げるが同時に脳灌流圧も高くなっていた。全身の血行動態に対しては一部の患者では有用(低血圧に対する血管作動薬の投与量を減らせた)であるが、ケタミンの用量や心血管系疾患の既往によっては有害(心不全や心筋虚血を悪化させる)であった。他の非無作為化試験の結果もこれらの研究の結果とほぼ同様であった。
✔ ケタミンによる鎮痛鎮静の実際
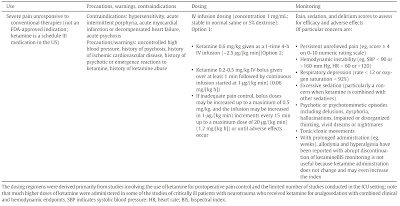
ケタミン使用の実際を示す(表)。これは重篤な疼痛を訴える患者に対して第一選択と考えられる従来の鎮痛薬(NSAIDSやオピオイド)をしっかりと使用したことを前提として設定されている投与計画である。従来の方法に対して反応が悪い場合にケタミンの使用を考えるが、反応が悪いということを明確に定義するものはない。おおむね最大投与量を使用しても疼痛があったり副作用が問題となる場合にケタミンの併用を考える。
過去の研究に示された投与計画は様々であるが、古い時代の研究は人工呼吸管理開始とともに中断することなく麻酔状態を達成するために鎮静薬が投与されていたことを考慮しなくてはならない。ここに記載してあるのはかなり姑息的な投与量としてあり、精神症状のような副作用でせん妄や他の中枢神経症状との鑑別に難渋しないようにすることを目標としている。ケタミンを長期間投与すると薬剤が蓄積し、回復に時間がかかる。そこで、ケタミンを持続投与する場合は毎日中断してSATすることを推奨する。他の方法としては1-time 4-hour法というものがあり、これは様々な癌性疼痛/非癌性疼痛に対して数日にわたる痛みを減らすために用いられる方法である。急激な疼痛に対してはボーラス投与が必要であり、0.2~0.5㎎/kgという投与量を推奨している。しかし、高用量では健常人でも意識消失する可能性があるため、下限の0.2㎎/kgから始めるほうが良い。処置時の鎮静のように意識消失が必要である場合は1㎎/kgくらいの高用量が必要である。用量調節を柔軟に行うため、他の薬剤との混注は推奨しない。
◎ 私見
0.06mg/kg/hrで開始して最大1.2㎎/kg/hrまで増量可能。体重50㎏の人なら1時間あたり3㎎で開始して最大60㎎。熱傷患者とか若い多発外傷患者とか良いのかなと思ってはいるがこういった患者さんは痛みのためにDaily interuptionもしづらいし、長期投与にもなりがちだから悩ましいところ。
Patanwala AE, Martin JR, Erstad BL.
J Intensive Care Med. 2015 Dec 8. PMID: 26647407
✔ ICUにおけるケタミン(臨床研究)
ICUにおいてケタミンを少なくとも24時間連続投与して従来の薬剤の効果と比較した臨床研究は六つある。Guillouらのモルヒネ投与量減少効果を報告した93例を対象とした研究を除くと、各々の研究は30例を超えることのない小規模な研究ではあるが、消化管機能や脳血管系、心臓血管系への影響を調査している。サンプルサイズが小さいという問題はあるが、これらの研究によると、重症頭部外傷に対して脳血管系には有意な副作用はなく、高用量投与においてわずかに(1~2㎜Hg)頭蓋内圧を上げるが同時に脳灌流圧も高くなっていた。全身の血行動態に対しては一部の患者では有用(低血圧に対する血管作動薬の投与量を減らせた)であるが、ケタミンの用量や心血管系疾患の既往によっては有害(心不全や心筋虚血を悪化させる)であった。他の非無作為化試験の結果もこれらの研究の結果とほぼ同様であった。
✔ ケタミンによる鎮痛鎮静の実際
ケタミン使用の実際を示す(表)。これは重篤な疼痛を訴える患者に対して第一選択と考えられる従来の鎮痛薬(NSAIDSやオピオイド)をしっかりと使用したことを前提として設定されている投与計画である。従来の方法に対して反応が悪い場合にケタミンの使用を考えるが、反応が悪いということを明確に定義するものはない。おおむね最大投与量を使用しても疼痛があったり副作用が問題となる場合にケタミンの併用を考える。
過去の研究に示された投与計画は様々であるが、古い時代の研究は人工呼吸管理開始とともに中断することなく麻酔状態を達成するために鎮静薬が投与されていたことを考慮しなくてはならない。ここに記載してあるのはかなり姑息的な投与量としてあり、精神症状のような副作用でせん妄や他の中枢神経症状との鑑別に難渋しないようにすることを目標としている。ケタミンを長期間投与すると薬剤が蓄積し、回復に時間がかかる。そこで、ケタミンを持続投与する場合は毎日中断してSATすることを推奨する。他の方法としては1-time 4-hour法というものがあり、これは様々な癌性疼痛/非癌性疼痛に対して数日にわたる痛みを減らすために用いられる方法である。急激な疼痛に対してはボーラス投与が必要であり、0.2~0.5㎎/kgという投与量を推奨している。しかし、高用量では健常人でも意識消失する可能性があるため、下限の0.2㎎/kgから始めるほうが良い。処置時の鎮静のように意識消失が必要である場合は1㎎/kgくらいの高用量が必要である。用量調節を柔軟に行うため、他の薬剤との混注は推奨しない。
 |
| ケタミン投与法(文献より引用) |
0.06mg/kg/hrで開始して最大1.2㎎/kg/hrまで増量可能。体重50㎏の人なら1時間あたり3㎎で開始して最大60㎎。熱傷患者とか若い多発外傷患者とか良いのかなと思ってはいるがこういった患者さんは痛みのためにDaily interuptionもしづらいし、長期投与にもなりがちだから悩ましいところ。
2016年7月11日月曜日
ケタミンによる鎮痛鎮静②
Ketamine for Analgosedation in the Intensive Care Unit: A Systematic Review.
Patanwala AE, Martin JR, Erstad BL.
J Intensive Care Med. 2015 Dec 8. PMID: 26647407
✔ 副作用
ケタミンはその特異な薬理作用のため、副作用についても他の鎮痛薬とは全く異なっている。例えばNSAIDSのような消化管や腎への悪影響がない。またオピオイドと異なりµ受容体に作用しないため消化管運動障害がない。また、咽頭や喉頭の防御的反射機能に影響せず、気道抵抗を低減し、肺コンプライアンスを高め、呼吸抑制を起こすこともない(大量急速投与しなければ)。このような呼吸器系への有用な作用のため、喘息重責発作の人工呼吸管理のような状況における有用性が示唆される。気道内にかかる圧が高くなることにより(訳者註:圧がかかりやすくなる、という意味か?)肺高血圧を悪化させる可能性があるため、そのような状況では注意が必要である。要約すると、オピオイドのような他の鎮痛薬と異なりケタミンは消化管や呼吸器系に重篤な副作用を起こしづらく、重症患者においても十分に従来の鎮痛薬の代替となりうると言える。
中枢神経系に関しては、オピオイドが全般的に抑制を起こすのとは対照的にケタミンは興奮と抑制の両者を引き起こす。このため、ケタミンは痙攣を誘発すると考えられており、実際痙攣が誘発されたとする症例報告がある。しかし、もともと転換の既往のある患者を対象とした研究では、痙攣を誘発することなくむしろ痙攣脳波を抑制したと報告している。初期の研究で報告された痙攣誘発については、モニタが適切ではなかった、脳波記録と中枢神経興奮に関する誤った結論、他の誘因の存在、ケタミン投与に伴う骨格筋痙攣をてんかん発作と誤認した、などの解釈がなされている。近年の報告ではてんかん重積に有用であったとするものもあるが、エビデンスが欠けておりガイドラインにおいても最終手段として紹介されているに過ぎない。以上より、頭部外傷のような痙攣のリスクの高い患者においても、ICUで短期間使用するのであれば特に問題はないであろうと考えられる。
ケタミンは精神作用があることがよく知られている。約30%の成人において、覚醒時に幻覚や精神病様の症状のような”覚醒時反応”が認められた。投与量と精神作用には関連がなく、徐々に投与量を変化させることで精神作用を減じることができたとする報告がある。低用量(1㎎/kg緩徐投与)、低血漿濃度(<100ng/ml)でも統合失調症様ないし解離症状が出現しうる。この点から、重症患者ではせん妄の原因となって予後を悪化させるのではないかと考えられてきた。例えば、近年のシステマチックレビューで、せん妄を起こした重症患者はそうではない患者と比べて死亡のリスクが高くICU在室日数や在院日数が長くなることが示されている。この精神作用に対し、それ自体もせん妄の原因とはなりうるが、ベンゾジアゼピンが予防のために用いられている。ベンゾジアゼピンはP450系を介してケタミンと相互作用し、その作用を延長する。一般に精神症状や離脱症候群を起こしたことがある患者ではケタミンは避けたほうが良い。ケタミンを鎮痛鎮静に用いるのであれば徐々に投与量を増減し、精神症状について注意深くモニタすることを推奨する。
ケタミンの心血管系に対する作用は他の鎮静薬とは全く異なっており、注目に値する。ケタミンは交感神経系刺激作用があり、アドレナリンの作用を増強するが、これによって心筋に対する直接的な収縮抑制作用が拮抗される。また、再取り込みを抑制することで全身のカテコラミン濃度を増加させる。心拍数や血圧は上昇するため、他の鎮静薬とは全く反対の作用をもたらすことになる。これは健常者で認められる効果であるが、カテコラミンが減っている万世紀にある重症患者でも同様の効果があるかどうかはわからない。一つの研究ではあるが、重症患者ではケタミンで血圧が低下することが報告されている。ケタミンにより頭蓋内圧が上昇する可能性があるが、システマチックレビューではこのような現象の証拠は示されなかった。ケタミンは投与量を調整すれば血行動態が不安定な重症患者でも安全であるが、虚血性心疾患がある患者では避けたほうがよいだろう。
◎ 私見
このあたりの記述は麻酔科医ならほぼ常識かな。頭蓋内圧や痙攣誘発、重症患者の血行動態に与える影響などのニュアンスについても同様。こういう癖のある薬を協働する他の科の医師やパラメディカルの方々に合わせて調整していけるかどうかが実は大変なのではないかと思ったりする。
Patanwala AE, Martin JR, Erstad BL.
J Intensive Care Med. 2015 Dec 8. PMID: 26647407
✔ 副作用
ケタミンはその特異な薬理作用のため、副作用についても他の鎮痛薬とは全く異なっている。例えばNSAIDSのような消化管や腎への悪影響がない。またオピオイドと異なりµ受容体に作用しないため消化管運動障害がない。また、咽頭や喉頭の防御的反射機能に影響せず、気道抵抗を低減し、肺コンプライアンスを高め、呼吸抑制を起こすこともない(大量急速投与しなければ)。このような呼吸器系への有用な作用のため、喘息重責発作の人工呼吸管理のような状況における有用性が示唆される。気道内にかかる圧が高くなることにより(訳者註:圧がかかりやすくなる、という意味か?)肺高血圧を悪化させる可能性があるため、そのような状況では注意が必要である。要約すると、オピオイドのような他の鎮痛薬と異なりケタミンは消化管や呼吸器系に重篤な副作用を起こしづらく、重症患者においても十分に従来の鎮痛薬の代替となりうると言える。
中枢神経系に関しては、オピオイドが全般的に抑制を起こすのとは対照的にケタミンは興奮と抑制の両者を引き起こす。このため、ケタミンは痙攣を誘発すると考えられており、実際痙攣が誘発されたとする症例報告がある。しかし、もともと転換の既往のある患者を対象とした研究では、痙攣を誘発することなくむしろ痙攣脳波を抑制したと報告している。初期の研究で報告された痙攣誘発については、モニタが適切ではなかった、脳波記録と中枢神経興奮に関する誤った結論、他の誘因の存在、ケタミン投与に伴う骨格筋痙攣をてんかん発作と誤認した、などの解釈がなされている。近年の報告ではてんかん重積に有用であったとするものもあるが、エビデンスが欠けておりガイドラインにおいても最終手段として紹介されているに過ぎない。以上より、頭部外傷のような痙攣のリスクの高い患者においても、ICUで短期間使用するのであれば特に問題はないであろうと考えられる。
ケタミンは精神作用があることがよく知られている。約30%の成人において、覚醒時に幻覚や精神病様の症状のような”覚醒時反応”が認められた。投与量と精神作用には関連がなく、徐々に投与量を変化させることで精神作用を減じることができたとする報告がある。低用量(1㎎/kg緩徐投与)、低血漿濃度(<100ng/ml)でも統合失調症様ないし解離症状が出現しうる。この点から、重症患者ではせん妄の原因となって予後を悪化させるのではないかと考えられてきた。例えば、近年のシステマチックレビューで、せん妄を起こした重症患者はそうではない患者と比べて死亡のリスクが高くICU在室日数や在院日数が長くなることが示されている。この精神作用に対し、それ自体もせん妄の原因とはなりうるが、ベンゾジアゼピンが予防のために用いられている。ベンゾジアゼピンはP450系を介してケタミンと相互作用し、その作用を延長する。一般に精神症状や離脱症候群を起こしたことがある患者ではケタミンは避けたほうが良い。ケタミンを鎮痛鎮静に用いるのであれば徐々に投与量を増減し、精神症状について注意深くモニタすることを推奨する。
ケタミンの心血管系に対する作用は他の鎮静薬とは全く異なっており、注目に値する。ケタミンは交感神経系刺激作用があり、アドレナリンの作用を増強するが、これによって心筋に対する直接的な収縮抑制作用が拮抗される。また、再取り込みを抑制することで全身のカテコラミン濃度を増加させる。心拍数や血圧は上昇するため、他の鎮静薬とは全く反対の作用をもたらすことになる。これは健常者で認められる効果であるが、カテコラミンが減っている万世紀にある重症患者でも同様の効果があるかどうかはわからない。一つの研究ではあるが、重症患者ではケタミンで血圧が低下することが報告されている。ケタミンにより頭蓋内圧が上昇する可能性があるが、システマチックレビューではこのような現象の証拠は示されなかった。ケタミンは投与量を調整すれば血行動態が不安定な重症患者でも安全であるが、虚血性心疾患がある患者では避けたほうがよいだろう。
 |
| ケタミンの薬理作用(文献より引用) |
このあたりの記述は麻酔科医ならほぼ常識かな。頭蓋内圧や痙攣誘発、重症患者の血行動態に与える影響などのニュアンスについても同様。こういう癖のある薬を協働する他の科の医師やパラメディカルの方々に合わせて調整していけるかどうかが実は大変なのではないかと思ったりする。
2016年7月8日金曜日
ケタミンによる鎮痛鎮静①
Ketamine for Analgosedation in the Intensive Care Unit: A Systematic Review.
Patanwala AE, Martin JR, Erstad BL.
J Intensive Care Med. 2015 Dec 8. PMID: 26647407
Patanwala AE, Martin JR, Erstad BL.
J Intensive Care Med. 2015 Dec 8. PMID: 26647407
✔ イントロダクション
ケタミンは1962年に合成され、1964年に臨床試験された。当初、解離性麻酔薬として使用されていたが時を置かずに鎮痛薬として使用されるようになった。術後の慢性疼痛やCRPSといった非重症患者を対象とする臨床試験が数多く施行された。オピオイドは鎮痛鎮静薬の基本だが重症患者に応用する際には副作用が問題となる。ケタミンは低用量では特異な鎮痛鎮静作用を持ち、高用量では麻酔薬として作用するが、ICUにおける有用性を検討した研究はほとんどない。
近年発表されたPADガイドラインではエビデンスの欠如が指摘されており、わずかに神経因性疼痛に対する非オピオイド性鎮痛薬の一種としてのみ触れらている程度である。現在のところ、ICU患者に対するケタミンの持続投与の効果を検証したシステマチックレビューはひとつのみである。
エビデンスが欠けているにもかかわらずケタミンはICUで使用されているが、有効な症例や用量、モニタ法についてはわかっていない。このレビューは成人重症患者にケタミンをしようとするときに有用なガイドとなることを目的としている。
✔ 薬力学・薬理作用
他の薬剤と同様、個々の症例において分布容積やクリアランスはかなり異なる。さらにこのばらつきは重症患者でより大きくなる。このことから、特に肥満患者で持続的に投与することで脂肪組織に蓄積し、再分布によって作用が遷延するのではないかと考えられる。血漿中でアルブミンやα1棟蛋白と結合するケタミンは50%未満であり、臨床的に有意な蛋白結合による作用の変化はないと考えられる。米国においてケタミンはラセミ体で提供されているが、より鎮痛作用の強いS体の製剤が他国では売られている。ケタミンはP450系で代謝されて約3分の1の活性のあるノルケタミンとなるが、特定のミクソームの酵素や代謝部位、薬物ー酵素連関、薬物相互作用についてはまだ明らかになっていない。
ケタミンの薬理作用はNMDA受容体を遮断することによってもたらされるが、用量や濃度によってはオピオイド受容体遮断作用やGABA抑制、中枢神経や末梢組織における神経伝達を修飾するような作用もある。濃度依存性の鎮痛作用や麻酔作用が示されているが、TDMが行えるような体制とはなっていない。
 |
| ケタミンの薬理(文献より引用) |
◎ 私見
ケタミンはICUではほとんど使ったことがなく、もっぱら救急外来における処置時の鎮痛鎮静に用いていた。オピオイドなどの手段による鎮痛に限界を感じる症例が数例あり、新しいアプローチを模索している最中であったのでこのショートレビューを読んだ。大学院生の時に神経保護の観点からケタミンを勉強したことがあり、自分にとってはなんとなく身近に感じる薬で使うことに抵抗はないのだけど、他の先生方はどうなのだろう?
2016年7月5日火曜日
ハロペリドール無効のせん妄にデクスメデトミジンは有効
Dexmedetomidine for the Treatment of Hyperactive Delirium Refractory to Haloperidol in Nonintubated ICU Patients: A Nonrandomized Controlled Trial.
Carrasco G, Baeza N, Cabré L, Portillo E, Gimeno G, Manzanedo D, Calizaya M.
Crit Care Med. 2016 Jul;44(7):1295-306. PMID: 26925523
Carrasco G, Baeza N, Cabré L, Portillo E, Gimeno G, Manzanedo D, Calizaya M.
Crit Care Med. 2016 Jul;44(7):1295-306. PMID: 26925523
✔ 背景
せん妄はICU合併症として頻度が高い。国際的なガイドラインではハロペリドールがせん妄に対して推奨されているが、ハロペリドールが禁忌の症例や高用量でも無効な場合にどのような選択肢があるのかは示されていない。そこで、活発型のせん妄を呈する非挿管患者に対してデクスメデトミジンを用いることの有用性について検討した。
✔ 方法
非無作為化比較対照試験。Medical-Surgical ICUに入室した連続する活発型せん妄患者を対象とした。全症例はまずハロペリドールをRASS 0~-2になるか一日の最大投与量に達するまで投与した。次いで、ハロペリドールが有用であった群を対照とし、無効であった群にデクスメデトミジン(DEX)を投与した。
・ハロペリドール投与法
初期鎮静:2.5~5㎎を10~30分おきに投与。1日の最大量は30㎎に設定した
維持鎮静:ハロペリドールが有効であった場合、0.5~1㎎/hrで持続投与した
・DEX投与方法
ハロペリドールによる初期鎮静無効例に対して上記のハロペリドール維持鎮静に加えてDEXを0.2µg/kg/hrで持続投与した(ボーラスはしない)。さらにRASS 0を達成するために0.7µg/kg/hrまで増量した。ハロペリドールは漸減した。
✔ 結果
132例が対象となった。46例(34.8%)はハロペリドールが無効であり、残りの86例(65.2%)は有効であった。DEXを投与すると、大部分の患者に対して安全で良好な鎮静レベルを達成できた(92.7%)。ハロペリドールは過鎮静(11.6%)やQT延長(2.0%)の原因となった。DEXはハロペリドールより高コスト(17倍)であるが、ICU在室日数を減らすため、最終的には4370ドルの経費節減となった。
✔ 結論
DEXはハロペリドールが無効である非挿管患者の活発型せん妄に対し、安全かつ有効であり、コストも安い。
◎ 私見
ハロペリドールが有効であった群と無効であった群で比較しているという点に注意が必要だが、それを差し引いてもDEXは良さそうである。それにしてもハロペリドール有効群の1日投与量の平均が40㎎近い。5㎎のアンプルを1日8本使う計算である。日本でもこのような使い方をしている施設ってあるのだろうか?(当施設はこの量の半分以下しか使われていない)
2016年7月2日土曜日
ICUにおける身体診察②
Bedside Diagnosis in the Intensive Care Unit. Is Looking Overlooked?
Metkus TS, Kim BS.
Ann Am Thorac Soc. 2015 Oct;12(10):1447-50. PMID: 26389653
Metkus TS, Kim BS.
Ann Am Thorac Soc. 2015 Oct;12(10):1447-50. PMID: 26389653
✔ 身体診察の実状
エビデンスの欠けた状況では、施設が違えば身体診察に関する態度も変わってくるだろう。また、体位変換、不安定性、ドレッシング、点滴ライン、チューブ、モニタコード、騒音などの身体診察を難しくする要素がICUには存在する。
ICUにおける身体診察は系統的なアプローチがよいと思われるが、その実際についてはほとんどデータがない。ある調査では、研修医や医学生、看護師は患者診察を行うが、指導医は時々診察するか全くしないという状況であった。
あるICUではすべての患者に対して医師、看護師、学生からなるチームが回診時に診察を行っていた。一方で他のICUでは研修医が回診前に予診を行い回診時に報告するも、上級医はその所見を確認していなかった。
電子カルテに記載された診察所見が記述者自身が確認した所見のみで構成されることはほとんどないということも考えなくてはならない。2006年の調査では、25%の記述はコピーペーストされたものであった。最近のものはもっと悪くなっており、4分の3の医師が作成した記述のなかに20%以上のコピーペーストが認められている。
医師は回診前、回診後、回診中に診察するか、もしくは全くしない。新しい重症患者が入室するとチームはそちらにかかりきりになり、ほかの患者の診察は後回しになる。感染予防のために隔離処置されていたり、検査中ないし手技中の場合も同様である。実際、ある調査では医師は通常の患者の73%を診察するが(これも低い数字ではあるが)、隔離中では35%に減少することが示されている。ICUにおける標準的ない身体診察というものは存在しないし、どれが有用かもわかっておらず、診察チームに誰が含まれるべきかもわかっていないのである。
✔ 我々の方法
系統的な身体診察はそれなりに価値があると考えている。ベッドサイドでの評価には身体診察だけでなく、カテーテルや医療機器、術創部、モニタの数字、呼吸器の波形モニタなどの評価も含まれ、家族の様子なども評価対象となる。
評価はチェックリストを用いて行う。多職種チームで診察をすることで教育や学習効果も期待できる。診断は、それ単独では誤診につながるといわれる画像や血行動態モニタを適切に参照して行う。このようなアプローチには時間がかかるが、家族はICUでのケアに満足する。ベッドサイドでの”手当て”はハイテク機器や高度な治療のために非人間化されがちなICUにおいて、人間らしさをもたらす。
◎ 私見
以下、超音波検査を組み込むこと、系統的身体診察の有用性を検討するためのRCTが望まれることが述べられている。
「ICU患者の評価」をどのように行うのが良いのか、ここのところずっと気になっている。他の施設の他の先生方はどうしているのだろう? 何から始めて、どれくらい時間をかけて、カルテにどのように記載するのか。JSEPTICのアンケートでやらないかな・・・
ICUにおける身体診察は系統的なアプローチがよいと思われるが、その実際についてはほとんどデータがない。ある調査では、研修医や医学生、看護師は患者診察を行うが、指導医は時々診察するか全くしないという状況であった。
あるICUではすべての患者に対して医師、看護師、学生からなるチームが回診時に診察を行っていた。一方で他のICUでは研修医が回診前に予診を行い回診時に報告するも、上級医はその所見を確認していなかった。
電子カルテに記載された診察所見が記述者自身が確認した所見のみで構成されることはほとんどないということも考えなくてはならない。2006年の調査では、25%の記述はコピーペーストされたものであった。最近のものはもっと悪くなっており、4分の3の医師が作成した記述のなかに20%以上のコピーペーストが認められている。
医師は回診前、回診後、回診中に診察するか、もしくは全くしない。新しい重症患者が入室するとチームはそちらにかかりきりになり、ほかの患者の診察は後回しになる。感染予防のために隔離処置されていたり、検査中ないし手技中の場合も同様である。実際、ある調査では医師は通常の患者の73%を診察するが(これも低い数字ではあるが)、隔離中では35%に減少することが示されている。ICUにおける標準的ない身体診察というものは存在しないし、どれが有用かもわかっておらず、診察チームに誰が含まれるべきかもわかっていないのである。
✔ 我々の方法
系統的な身体診察はそれなりに価値があると考えている。ベッドサイドでの評価には身体診察だけでなく、カテーテルや医療機器、術創部、モニタの数字、呼吸器の波形モニタなどの評価も含まれ、家族の様子なども評価対象となる。
評価はチェックリストを用いて行う。多職種チームで診察をすることで教育や学習効果も期待できる。診断は、それ単独では誤診につながるといわれる画像や血行動態モニタを適切に参照して行う。このようなアプローチには時間がかかるが、家族はICUでのケアに満足する。ベッドサイドでの”手当て”はハイテク機器や高度な治療のために非人間化されがちなICUにおいて、人間らしさをもたらす。
 |
| 系統的診察(文献より引用) |
以下、超音波検査を組み込むこと、系統的身体診察の有用性を検討するためのRCTが望まれることが述べられている。
「ICU患者の評価」をどのように行うのが良いのか、ここのところずっと気になっている。他の施設の他の先生方はどうしているのだろう? 何から始めて、どれくらい時間をかけて、カルテにどのように記載するのか。JSEPTICのアンケートでやらないかな・・・
2016年6月28日火曜日
ICUにおける身体診察①
Bedside Diagnosis in the Intensive Care Unit. Is Looking Overlooked?
Metkus TS, Kim BS.
Ann Am Thorac Soc. 2015 Oct;12(10):1447-50. PMID: 26389653
Metkus TS, Kim BS.
Ann Am Thorac Soc. 2015 Oct;12(10):1447-50. PMID: 26389653
You can observe a lot just by watching.
-Yogi Berra
✔ 緒言
64歳男性。大動脈弁置換術後5日目で心房細動を合併している。「混乱しているようだ」とのこと。診察してみると、左顔面の弛緩、左上下肢の脱力、左空間無視があった。3時間前の診察時には神経学的異常なし。画像所見で右中大脳動脈閉塞が判明し、緊急血栓除去が行われた。症状は改善し、最終的には軽微な後遺症のみで退院した。
73歳女性。ショック状態でICU入室。尿中白血球陽性で尿路感染症による敗血症と診断。診察したところ、脈圧が狭小化しており頚静脈圧が20㎝H2Oであった。大腿動脈ならびに橈骨動脈拍動は吸気時に消失する奇脈を呈していた。経胸壁エコーを行ったところ心嚢液が貯留しており、心タンポナーデと判断した。心嚢ドレナージが行われ、ショックから離脱した。
身体診察は患者評価の要であり、医学部教育や卒後教育においても重要な要素である。前述の症例のように重症患者においてもベッドサイドでの診察が救命につながることがある。しかし、ICUにおける身体診察の有用性に関するデータはほとんどなく、ガイドラインもない。
ICUでの身体診察をどのように行っているかについては施設間でのばらつきが大きく、医学教育や患者予後への影響、診断的検査の過剰使用や過少適用が存在することを示唆するものである。
✔ 身体診察の有用性
身体診察の有用性については様々な意見がある。Vergheseらは診断的価値だけでなく医師患者関係の構築にも有用と報告している。しかしICUにおける身体診察を支持する研究はほとんどない。クリティカルケアの場では身体診察は有用ではないと考えられがちで、教科書でも特別に章をさいて解説してあるものはない。
これには、身体診察所見が有用ではないと報告されていることが関係しているのだろう。例えば、頚静脈圧は充満圧が高いことは予測できるが輸液反応性を予測できない。同様に、超音波検査と比較して聴診では胸水や浸潤影を正確に診断できず、両肺の呼吸音聴取だけでは片肺挿管を否定できないということが示されている。
身体診察の有用性を評価する研究の問題は、診察者の経験である。Sapiraもショパンの法則(わたしはショパンを全く弾けないが、上手に弾ける人はいる)と言っている。もし経験豊かな診察者が関与していたら、臨床研究の結果は全く違ったものになっていたかもしれない。
反対に身体所見が有用であると報告している研究もある。バイタルサインの異常が重大なイベント発生を予測することが示されている。これは自明のことのように思われるが、計測の正確性に依存することに注意が必要である。例えば、3分の1の症例で記録された呼吸数と実際の呼吸数とが異なっていたことが報告されている。呼吸音が肺炎発症を予測したりベッドサイドにおける呼吸窮迫のゲシュタルトが気管挿管の必要性を判定できたりすることも示されている。せん妄は予後悪化因子であるが、CAM-ICUなどによる正確な判定が必要である。
身体診察と予後を調べた研究はないが、小規模な研究で100人中26人の診断や治療を変更させたというものがある。
◎ 私見
冒頭の「たくさんしっかり見れば観察できる」というYogiの言葉は深いのか浅いのかよくわからないが・・・。
身体診察は有用だと思う(思いたい)。有用だと言えるような医師になりたいし、そのような技術を身につけたい。少なくとも、ローテートしてきた研修医が患者評価をモニタの数字を見ることだと誤解してしまうようなことのないようにしなければならないと思っています。
身体診察は有用だと思う(思いたい)。有用だと言えるような医師になりたいし、そのような技術を身につけたい。少なくとも、ローテートしてきた研修医が患者評価をモニタの数字を見ることだと誤解してしまうようなことのないようにしなければならないと思っています。
2016年6月25日土曜日
重症低酸素血症の治療戦略③
Severe hypoxemia: which strategy to choose.
Chiumello D, Brioni M.
Crit Care. 2016 Jun 3;20(1):132. PMID: 27255913
✔ 筋弛緩薬
筋弛緩薬は呼吸器の同調性を改善して呼吸筋の酸素消費量を最小にし、呼吸努力を消失させるためにしばしば用いられる。さらに、自発吸気努力によって生じる胸腔内陰圧とそれによってもたらされるストレス/ストレインを減らすことができる。しかし、筋弛緩薬はICU acquired weaknessや横隔膜機能不全、人工呼吸期間延長の原因となる。ARDSにおける意義を調べるため、いくつかの臨床研究が行われた。2004年にGainnierらは重症ARDSを対象とし、深鎮静に48時間の筋弛緩薬を追加する意義を調査した。両群間で気道内圧やPEEP、鎮静薬投与量には差がなかったが、筋弛緩薬投与群では投与開始48時間、96時間、120時間後の酸素化が良好であった。さらに小規模なRCTによると、48時間の筋弛緩薬投与によって肺局所ないし全身性の炎症性サイトカイン(IL-6、IL-8)が有意に低値となり、PEEPを低くでき、酸素化が良好であった。340人の重症ARDSを対象とした大規模多施設RCTでは48時間の筋弛緩薬持続投与によって90日死亡率が有意に減少し、人工呼吸管理期間が短縮され、気胸発生率が低値であったことが報告された。ICU退室時の筋力低下には両群間に有意差はなかった。引き続いて発表されたメタアナリシスでは、筋弛緩薬投与によって死亡率が低下し(RR 0.71)、人工呼吸管理期間が短縮し、圧損傷が減ることが示された。
現状の研究結果に基づくと、筋弛緩薬は重症ARDSの急性期の数時間において、同調性を改善して危険な経肺圧が生じないようにするために用いるべきである。ただし、人工呼吸器の設定や筋弛緩薬の必要性については毎日評価すべきである。
✔ 腹臥位
30年以上前の観察研究で、腹臥位が急性呼吸不全患者の酸素化を改善することは知られており、腹臥位は重度低酸素血症におけるレスキュー治療として位置づけられるようになった。肺における含気の再分布と背側肺のリクルートメント、胸壁エラスタンスの改善、肺内シャントの減少、換気血流日の改善、換気の均質化によるVILI予防、右心不全の改善がそのメカニズムである。これに基づき、1996年からARDSを対象としたRCTがいくつか行われた。肺保護換気をしていない中等度~重度ARDSを対象として検討したところ、短時間(1日8時間まで)の腹臥位は予後を改善しなかった。より重度の低酸素血症をきたしている症例を対象としてより長時間(1日20時間)の腹臥位の効果を検討したところ、やはり有効ではなかった。しかし、これらの研究のメタアナリシスではP/F<140のような重度低酸素血症においては生存率を改善するかもしれないという結果であった。このような背景のもと、Guerinらは重度ARDSを対象とし、少なくとも1日16時間という長時間の腹臥位換気の効果を多施設無作為化研究で検討した。PEEPはALVEOLI研究のLow PEEP群で用いられた表を参考にして設定し、一回換気量は理想体重当たり6mlで厳密に管理した。28日死亡率は腹臥位換気群で有意に低く(16% vs 32%)、抜管成功率が高かった。その腹臥位換気時間の平均値は17時間であった。
人工呼吸器の有害作用を腹臥位換気と筋弛緩薬は減じることができるが、この両者を組み合わせると相乗的に作用して酸素化を改善し、人工呼吸管理期間を短縮し、最終予後を改善する。
ベルリン定義によると、腹臥位は重度ARDSの急性期(肺水腫や無気肺が多く、リクルートメント可能な肺容量も大きい)において長時間行うべきとされる。酸素化が改善しない患者もいないわけではないが、VILIを減らすという利点があることを考えるべきである。技術的には難しい点もあるが、よく訓練されたチームで管理すれば、合併症に伴う不利益を腹臥位の利益が上回る。腹臥位を行う前には妊娠、不安定な骨折、Open abdomen、循環動態不安定などの禁忌がないことを評価すべきである。
✔ ECMO
標準的には、上大静脈ないし下大静脈から脱血し、右房に送血するというVV回路で行われる。人工肺によって酸素化と換気が適正化されるため、人工呼吸器の設定を弱め、VILIを予防できる。当初、ECMOを用いても急性呼吸不全患者に利益があることを示すことができなかったが、1985年ころからいくつかの研究で死亡率を減らす可能性が報告されるようになった。しかし、無作為化研究で検討したものはCESAR試験しかない。この研究ではARDS患者はECMO管理ができる単施設に紹介され、通常治療群とECMO治療群に無作為に割り付けられた。ECMO中の人工呼吸器の設定は”Lung rest”の設定とされた。6か月後の生存率はECMO治療群で有意に高かった。ただし、通常治療群の呼吸器設定が厳密に標準化されておらず30%は肺保護換気の設定となっていなかったことや、全症例を熟練した単施設に転送しているという問題点が批判の対象となっている。よって、ECMOが通常治療に比べて優っていると断言はできない。にもかかわらず、その理論的背景からECMOは全世界で使用が増えている。まだ明らかなエビデンスとは言えないことに注意が必要である。例えば、スカンジナビアの臨床ガイドラインによると、ARDSに対する治療戦略にECMOは考慮されていない。
限られた医療資源を適切に適用するため、SchmidtらはECMOによって生存できるかどうかを正確に予測するための因子を、2355人の大規模データベースを用いて抽出した。
VILIはECMOによっても完全に予防はできないため、通常換気を行っている状態と同じように、腹臥位を組み合わせるべきである。ECMOと腹臥位の併用についてはデータがほとんどないが、KimmounらはARDSに対してECMO使用中に、24時間の腹臥位が合併症を増やすことなく酸素化を改善したことを報告している。
◎ 私見
より高度な管理方法について解説。筋弛緩薬は日本では難しいと思うが、根拠は全くないものの使いようによってはもしかしたら有用かもしれないとは思う(筋弛緩モニタを用いた軽度筋弛緩など)。腹臥位とECMOはどうか。気のせいかもしれないが、腹臥位をわき目にECMOに飛び付いてしまう人が多いような気がする。腹臥位は泥臭く、ECMOは洗練されているように感じるのかもしれないが、エビデンスの強度が違う。そういうところに真摯な態度をとれる人なら「ECMOをやるなら腹臥位ももっとやるべき」となるはずで、そうでなければちょっとどうなのかなと思ってしまう。
Chiumello D, Brioni M.
Crit Care. 2016 Jun 3;20(1):132. PMID: 27255913
✔ 筋弛緩薬
筋弛緩薬は呼吸器の同調性を改善して呼吸筋の酸素消費量を最小にし、呼吸努力を消失させるためにしばしば用いられる。さらに、自発吸気努力によって生じる胸腔内陰圧とそれによってもたらされるストレス/ストレインを減らすことができる。しかし、筋弛緩薬はICU acquired weaknessや横隔膜機能不全、人工呼吸期間延長の原因となる。ARDSにおける意義を調べるため、いくつかの臨床研究が行われた。2004年にGainnierらは重症ARDSを対象とし、深鎮静に48時間の筋弛緩薬を追加する意義を調査した。両群間で気道内圧やPEEP、鎮静薬投与量には差がなかったが、筋弛緩薬投与群では投与開始48時間、96時間、120時間後の酸素化が良好であった。さらに小規模なRCTによると、48時間の筋弛緩薬投与によって肺局所ないし全身性の炎症性サイトカイン(IL-6、IL-8)が有意に低値となり、PEEPを低くでき、酸素化が良好であった。340人の重症ARDSを対象とした大規模多施設RCTでは48時間の筋弛緩薬持続投与によって90日死亡率が有意に減少し、人工呼吸管理期間が短縮され、気胸発生率が低値であったことが報告された。ICU退室時の筋力低下には両群間に有意差はなかった。引き続いて発表されたメタアナリシスでは、筋弛緩薬投与によって死亡率が低下し(RR 0.71)、人工呼吸管理期間が短縮し、圧損傷が減ることが示された。
現状の研究結果に基づくと、筋弛緩薬は重症ARDSの急性期の数時間において、同調性を改善して危険な経肺圧が生じないようにするために用いるべきである。ただし、人工呼吸器の設定や筋弛緩薬の必要性については毎日評価すべきである。
✔ 腹臥位
30年以上前の観察研究で、腹臥位が急性呼吸不全患者の酸素化を改善することは知られており、腹臥位は重度低酸素血症におけるレスキュー治療として位置づけられるようになった。肺における含気の再分布と背側肺のリクルートメント、胸壁エラスタンスの改善、肺内シャントの減少、換気血流日の改善、換気の均質化によるVILI予防、右心不全の改善がそのメカニズムである。これに基づき、1996年からARDSを対象としたRCTがいくつか行われた。肺保護換気をしていない中等度~重度ARDSを対象として検討したところ、短時間(1日8時間まで)の腹臥位は予後を改善しなかった。より重度の低酸素血症をきたしている症例を対象としてより長時間(1日20時間)の腹臥位の効果を検討したところ、やはり有効ではなかった。しかし、これらの研究のメタアナリシスではP/F<140のような重度低酸素血症においては生存率を改善するかもしれないという結果であった。このような背景のもと、Guerinらは重度ARDSを対象とし、少なくとも1日16時間という長時間の腹臥位換気の効果を多施設無作為化研究で検討した。PEEPはALVEOLI研究のLow PEEP群で用いられた表を参考にして設定し、一回換気量は理想体重当たり6mlで厳密に管理した。28日死亡率は腹臥位換気群で有意に低く(16% vs 32%)、抜管成功率が高かった。その腹臥位換気時間の平均値は17時間であった。
人工呼吸器の有害作用を腹臥位換気と筋弛緩薬は減じることができるが、この両者を組み合わせると相乗的に作用して酸素化を改善し、人工呼吸管理期間を短縮し、最終予後を改善する。
ベルリン定義によると、腹臥位は重度ARDSの急性期(肺水腫や無気肺が多く、リクルートメント可能な肺容量も大きい)において長時間行うべきとされる。酸素化が改善しない患者もいないわけではないが、VILIを減らすという利点があることを考えるべきである。技術的には難しい点もあるが、よく訓練されたチームで管理すれば、合併症に伴う不利益を腹臥位の利益が上回る。腹臥位を行う前には妊娠、不安定な骨折、Open abdomen、循環動態不安定などの禁忌がないことを評価すべきである。
✔ ECMO
標準的には、上大静脈ないし下大静脈から脱血し、右房に送血するというVV回路で行われる。人工肺によって酸素化と換気が適正化されるため、人工呼吸器の設定を弱め、VILIを予防できる。当初、ECMOを用いても急性呼吸不全患者に利益があることを示すことができなかったが、1985年ころからいくつかの研究で死亡率を減らす可能性が報告されるようになった。しかし、無作為化研究で検討したものはCESAR試験しかない。この研究ではARDS患者はECMO管理ができる単施設に紹介され、通常治療群とECMO治療群に無作為に割り付けられた。ECMO中の人工呼吸器の設定は”Lung rest”の設定とされた。6か月後の生存率はECMO治療群で有意に高かった。ただし、通常治療群の呼吸器設定が厳密に標準化されておらず30%は肺保護換気の設定となっていなかったことや、全症例を熟練した単施設に転送しているという問題点が批判の対象となっている。よって、ECMOが通常治療に比べて優っていると断言はできない。にもかかわらず、その理論的背景からECMOは全世界で使用が増えている。まだ明らかなエビデンスとは言えないことに注意が必要である。例えば、スカンジナビアの臨床ガイドラインによると、ARDSに対する治療戦略にECMOは考慮されていない。
限られた医療資源を適切に適用するため、SchmidtらはECMOによって生存できるかどうかを正確に予測するための因子を、2355人の大規模データベースを用いて抽出した。
VILIはECMOによっても完全に予防はできないため、通常換気を行っている状態と同じように、腹臥位を組み合わせるべきである。ECMOと腹臥位の併用についてはデータがほとんどないが、KimmounらはARDSに対してECMO使用中に、24時間の腹臥位が合併症を増やすことなく酸素化を改善したことを報告している。
 |
| 治療選択フローチャート(文献より引用) |
より高度な管理方法について解説。筋弛緩薬は日本では難しいと思うが、根拠は全くないものの使いようによってはもしかしたら有用かもしれないとは思う(筋弛緩モニタを用いた軽度筋弛緩など)。腹臥位とECMOはどうか。気のせいかもしれないが、腹臥位をわき目にECMOに飛び付いてしまう人が多いような気がする。腹臥位は泥臭く、ECMOは洗練されているように感じるのかもしれないが、エビデンスの強度が違う。そういうところに真摯な態度をとれる人なら「ECMOをやるなら腹臥位ももっとやるべき」となるはずで、そうでなければちょっとどうなのかなと思ってしまう。
2016年6月22日水曜日
重症低酸素血症の治療戦略②
Severe hypoxemia: which strategy to choose.
Chiumello D, Brioni M.
Crit Care. 2016 Jun 3;20(1):132. PMID: 27255913
✔ 一回換気量
VILI発生の規定因子には非生理的なストレス(圧)とストレイン(歪み)があるが、これは換気量と安静時の肺容量の両者の関係によって決まる。換気量が小さく安静時の肺容量が大きいほど、高炭酸ガス血症とは関係なく肺を傷害するストレスやストレインは小さくなる。ARMA研究によると、一貫換気量を理想体重当たり12mlに設定した群に比べて6mlに設定した群では死亡率が22%小さくなった。Cochraneのメタアナリシスによると、一貫換気量を大きくした場合に比べて、換気量を小さくしてプラトー圧を30㎝H2O以下にすると死亡率が低下することが示されている。その筆者らは、低一回換気量をARDSの換気設定のルーチンにすべきで、これ以上の研究は行われるべきではないと結論づけている。しかし、ARMA研究から20年経過し、鎮静薬や筋弛緩薬を増やす必要もなく臨床的にも安全であると証明されているにもかかわらず、低一回換気量がルーチンに用いられているとは言い難い状況が続いている。
一回換気量は理想体重に基づいて決定されるが、理想体重は安静時肺容量とほとんど相関せず、同じような体格の患者を同じ換気量で換気しても異なるストレス/ストレインが生じることが分かっている。肺の含気と関係のある呼吸器系コンプライアンスと換気量から求められる換気駆動圧は、より正確にストレス/ストレインを反映する。Amatoらは換気駆動圧が最もARDSの予後と関係する因子であったことを報告している。つまり、換気駆動圧はVILIのリスクを勘案するにあたって有用なツールであるといえる。
✔ 人工呼吸のモード
現在最もよく用いられる人工呼吸のモードは従圧式換気(PCV)と従量式換気(VCVである。PCVでは換気量は呼吸器系のパラメータで修飾され、流量パターンは漸減波となる。VCVでは換気量は一定となるが気道内圧は様々となり、流量パターンは矩形となる。PCVは漸減波の流量パターンであるとともに疾患の程度によって換気量が変化するため、VILI予防に有利であると考えられてきたが、PCVとVCVを比較したChackoらのメタアナリシスでは死亡率や圧損傷の頻度に有意差はなかった。
自発呼吸のない強制換気に比べて自発呼吸のある補助換気では、鎮静レベルを減らし、呼吸金活動を維持し、より均質なガスの分布を期待できると考えられる。中等度ARDSを対象とした小規模なクロスオーバ研究では、PSV、PCV、NAVAにおいて換気量や肺にかかる圧は同等であったと報告されている。しかし、NIVと同様、重症ARDSに補助換気を不適切に用いると、経肺圧上昇や呼吸仕事量増加、浅く速い呼吸の出現によりVILIが増えてしまう。重症ARDSにおけるPSVやNAVAの意義を明らかにするにはさらなる研究が必要である。
✔ 酸素化と換気の目標
酸素飽和度の目標値は88~95%と言われているが、実際にはより安全であろうという考えから96%以上の高い値が維持されていることが多い。このような管理方法の有用性を検証するために、PanwarらはARDS患者を酸素飽和度96%以上に維持する群と88~92%に維持する群とに無作為に振り分けて予後を検討したが、臓器不全数や予後には有意差がなかった。
低一回換気量戦略を用いると高炭酸ガス血症となりうるが、大きな副作用もなく許容することができる。しかし、高炭酸ガス血症は吸気努力を増大させ、筋弛緩薬投与の独立した因子となる。適切な二酸化炭素分圧の値はよくわかっていないが、右心不全や頭蓋内圧上昇がなければ70㎜HgでpH 7.20までは安全であるといわれる。
◎ 私見
ARDSの人工呼吸管理では自発吸気努力をどのように制御するのが良いのかが難しい。よい筋弛緩薬がないので鎮静薬を増やしたり鎮痛薬を増やしたりするのだが、血圧が低下したりゆっくりとした深呼吸になってしまったり。Amato先生はPEEPを増やして対処する方法を示していたけど、実臨床でうまくいったと感じたことはあまりない。やり方が悪いのかな?
Chiumello D, Brioni M.
Crit Care. 2016 Jun 3;20(1):132. PMID: 27255913
✔ 一回換気量
VILI発生の規定因子には非生理的なストレス(圧)とストレイン(歪み)があるが、これは換気量と安静時の肺容量の両者の関係によって決まる。換気量が小さく安静時の肺容量が大きいほど、高炭酸ガス血症とは関係なく肺を傷害するストレスやストレインは小さくなる。ARMA研究によると、一貫換気量を理想体重当たり12mlに設定した群に比べて6mlに設定した群では死亡率が22%小さくなった。Cochraneのメタアナリシスによると、一貫換気量を大きくした場合に比べて、換気量を小さくしてプラトー圧を30㎝H2O以下にすると死亡率が低下することが示されている。その筆者らは、低一回換気量をARDSの換気設定のルーチンにすべきで、これ以上の研究は行われるべきではないと結論づけている。しかし、ARMA研究から20年経過し、鎮静薬や筋弛緩薬を増やす必要もなく臨床的にも安全であると証明されているにもかかわらず、低一回換気量がルーチンに用いられているとは言い難い状況が続いている。
一回換気量は理想体重に基づいて決定されるが、理想体重は安静時肺容量とほとんど相関せず、同じような体格の患者を同じ換気量で換気しても異なるストレス/ストレインが生じることが分かっている。肺の含気と関係のある呼吸器系コンプライアンスと換気量から求められる換気駆動圧は、より正確にストレス/ストレインを反映する。Amatoらは換気駆動圧が最もARDSの予後と関係する因子であったことを報告している。つまり、換気駆動圧はVILIのリスクを勘案するにあたって有用なツールであるといえる。
✔ 人工呼吸のモード
現在最もよく用いられる人工呼吸のモードは従圧式換気(PCV)と従量式換気(VCVである。PCVでは換気量は呼吸器系のパラメータで修飾され、流量パターンは漸減波となる。VCVでは換気量は一定となるが気道内圧は様々となり、流量パターンは矩形となる。PCVは漸減波の流量パターンであるとともに疾患の程度によって換気量が変化するため、VILI予防に有利であると考えられてきたが、PCVとVCVを比較したChackoらのメタアナリシスでは死亡率や圧損傷の頻度に有意差はなかった。
自発呼吸のない強制換気に比べて自発呼吸のある補助換気では、鎮静レベルを減らし、呼吸金活動を維持し、より均質なガスの分布を期待できると考えられる。中等度ARDSを対象とした小規模なクロスオーバ研究では、PSV、PCV、NAVAにおいて換気量や肺にかかる圧は同等であったと報告されている。しかし、NIVと同様、重症ARDSに補助換気を不適切に用いると、経肺圧上昇や呼吸仕事量増加、浅く速い呼吸の出現によりVILIが増えてしまう。重症ARDSにおけるPSVやNAVAの意義を明らかにするにはさらなる研究が必要である。
✔ 酸素化と換気の目標
酸素飽和度の目標値は88~95%と言われているが、実際にはより安全であろうという考えから96%以上の高い値が維持されていることが多い。このような管理方法の有用性を検証するために、PanwarらはARDS患者を酸素飽和度96%以上に維持する群と88~92%に維持する群とに無作為に振り分けて予後を検討したが、臓器不全数や予後には有意差がなかった。
低一回換気量戦略を用いると高炭酸ガス血症となりうるが、大きな副作用もなく許容することができる。しかし、高炭酸ガス血症は吸気努力を増大させ、筋弛緩薬投与の独立した因子となる。適切な二酸化炭素分圧の値はよくわかっていないが、右心不全や頭蓋内圧上昇がなければ70㎜HgでpH 7.20までは安全であるといわれる。
◎ 私見
ARDSの人工呼吸管理では自発吸気努力をどのように制御するのが良いのかが難しい。よい筋弛緩薬がないので鎮静薬を増やしたり鎮痛薬を増やしたりするのだが、血圧が低下したりゆっくりとした深呼吸になってしまったり。Amato先生はPEEPを増やして対処する方法を示していたけど、実臨床でうまくいったと感じたことはあまりない。やり方が悪いのかな?
2016年6月19日日曜日
重症低酸素血症の治療戦略①
Severe hypoxemia: which strategy to choose.
Chiumello D, Brioni M.
Crit Care. 2016 Jun 3;20(1):132. PMID: 27255913
Chiumello D, Brioni M.
Crit Care. 2016 Jun 3;20(1):132. PMID: 27255913
✔ 背景
ARDSはその診断の正確性を期するために診断基準の改定が数回行われているが、そもそもARDSの最も重要なポイントはシャントによる酸素投与抵抗性の低酸素血症である。重症低酸素血症には二つの閾値が提唱されているが(P/F<150 or 100)、どちらも死亡率は極めて高く(45%)、人工呼吸管理期間やVILIのリスクも高い。
ベルリン定義において、ARDSは陽圧換気を要する炎症性肺水腫と定義されている。肺水腫(肺重量)の増加により静水圧が上昇して含気量が減少し、含気のない部位が背側に生じる。
肺保護換気戦略と酸素投与量の調節を行うことでVILIを減らすことができるとされる。しかし、完全に安全な肺保護換気設定は存在せず、個々の患者の呼吸メカニクスやリクルート可能な部位の量、ガス交換能、血行動態に応じて最善と思われる方法を選択することになる。
✔ 非侵襲的換気
肺内シャントを減らして呼吸仕事量も減らすが、ARDSにおいては失敗のリスクや侵襲的換気の遅れにつながる可能性があり、結論が出ていない。NIVを標準的な治療に加えることで気管挿管を避けることができるかどうかについては大規模な臨床研究が必要である。近年報告されたメタアナリシスの13研究を見てみると、気管挿管率は30~86%、死亡率は15~71%とばらつきが大きく、無作為化されておらず、対象が不均一であり、気管挿管との直接比較もなかったため、結論を出すことができない。失敗のリスクを考えると、肺以外の臓器不全がなく、ICUで緊密にモニタできる状況下でのみ選択するべきであろう。数時間施行してもガス交換や呼吸数が改善しない場合はNIVをやめて侵襲的換気を開始すべきである。
NIVの代替手段としてHigh flow nasal cannula(HFNC)がある。HFNCは呼気終末の肺容量を増やし、呼吸仕事量を減らし、炭酸ガスの排泄を促進して酸素化も改善する。NIVとは異なり特別な(密着を要するような)インタフェイスを要さない点も特徴である。ARDSを対象とした研究ではHFNCを導入したものの40%は気管挿管に移行している。気管挿管の理由は、低酸素血症の進行、血行動態や意識レベルの悪化であった。この気管挿管率はAntonelliらのNIVをARDSに用いた研究の気管挿管率(46%)とほぼ同等である。現時点においては、HFNCとNIVと標準的な酸素投与法を比較した研究は一つだけある。気管挿管率に有意差はないものの、ICU死亡率はHFNC群で最も低かった。HFNCを使用する際の患者モニタリングは、現在のところNIVと同様である。
✔ PEEPと肺リクルートメント
肺保護換気においてPEEPとリクルートメント手技(RM)は別々に議論されることが多いが、両者は密接に関係している。肺領域を解放してその状態を維持するためには、肺組織と胸壁によって生じる圧に打ち克たなければならない。肺をリクルートする方法には、Sigh(高一回換気量を間歇的に行う)、Sustained inflation(静的高気道内圧を20~40秒維持する)、Extended sigh(PEEPを階段状に上昇させる)などがある。その目的は、つぶれている肺領域を高い経肺圧を適切な時間適用することで再開放することである。RMは大部分の患者の酸素化を一定期間改善することができるが、RM単独では死亡率を減らすことができない。
ここ数十年でPEEPの哲学は変化した。人工呼吸の歴史の始まりにおいては酸素化を改善する単純なツールであったものが、ここ数年で肺保護換気の枠組みにおいて、換気サイクル中の肺胞の開放・虚脱を避けて肺領域が不均質となるのを抑止するという役割を担うとみなされるようになった。肺水腫の程度によってリクルート可能な肺容量は0~70%と様々になる。患者移送とX線被曝の問題があるもののCTがその評価のゴールドスタンダードである。低線量プロトコルを用いた肺リクルートメントの視覚的評価は有用と思われる。さらに、CTによって約半数の患者の診断に寄与して治療方針を変えたとする報告もある。代替手段としては肺エコーの正確性が高いとされるが、さらなる研究が必要である。
いくつかの実験的研究や観察研究では、ARDSに対して高PEEPが有用であることを報告しているものの、無作為化試験(ALVEOLI、EXPRESS、LOV)では低PEEPと高PEEPで予後に有意差は認められなかった。しかし、重症患者群(P/F<200)のみに対象を絞ってメタ解析すると、高PEEPは死亡率を減らすことが分かった。つまり、重症度が高い(肺水腫の程度が強い)ほどPEEPのVILI減少効果が大きくなることを示している。リクルート可能な領域が大きい患者でのみ高PEEPは肺胞開放・虚脱サイクルを抑制できるとする近年の観察研究結果とも合致する。しかし、Cressoniらは肺の開放を維持するPEEPレベルとリクルートメント可能な肺領域の程度とは関係がないことを示し、肺水腫の程度とリクルートメント効果との相関関係に疑義を呈している。これらのことを合わせて考えると、肺水腫の程度だけでなく、発症からの時間、病変の分布などにもリクルートメントの効果は影響を受けるといえるだろう。
PEEPの調節にはいくつかの方法がある。一般的なのはPEEP/FIO2表を用いる方法である。他には、換気メカニクスに基づき、一回換気量を一定にして気道内圧が安全域を超えないように(26~28㎝H2O)PEEPを上昇させたり、RMの後にコンプライアンスを見ながらPEEPを減らす方法などがある。呼気終末の食道内圧が胸腔内圧を正確に反映するかどうかはよくわかっていないが、Talmorらは呼気終末の経肺圧が0~10㎝H2OとなるようにPEEPを設定すると、酸素化や肺コンプライアンスが改善することを報告している(絶対値法)。PEEPや一回換気量による食道内圧の変化から吸気終末の経肺圧を計算する方法もある(エラスタンス法)。Grassoらはこの方法を用いることで、通常の気道内圧を用いる方法に比べて酸素化を改善し、ECMOを避けることができたと報告している。しかし、この両者(絶対値法とエラスタンス法)を比較したところ、結果として得られた推奨PEEPの値にはばらつきが大きく、30%の症例ではPEEP変化の方向が逆になったとされている。
ガス交換、換気メカニクス、経肺圧に基づくPEEP設定と、リクルートメント可能な肺領域の量、重症度を比較したところ、ガス交換を参考にする方法(LOV試験のFIO2/PEEP表)のみが重症度に応じたPEEP設定となった一方、ほかの方法(換気メカニクス、経肺圧を参考する方法)ではほぼ同等のPEEPレベルとなり、これは患者の重症度やリクルート可能な肺領域の量とは相関しなかった。興味深いのは、肥満患者においては肺の含気は非肥満患者に比べて小さいものの、リクルートメントの効果や胸壁エラスタンスはほぼ同等であったことである。
現時点のデータを参照する限り、完璧なPEEP(酸素化、コンプライアンス、VILI減少効果が最大になるPEEP)は存在しないと言わざるを得ない。よって、急性期ではPEEPを決める前にARDSの重症度を層別化することから始める。これはPEEP 5㎝H2Oで淳酸素を用いて換気することで容易に行える。重度ARDSではリクルートメント可能な肺容量ををCTや肺エコーを用いて計算し、LOV試験のPEEP/FIO2表を用いて高PEEP(>15㎝H2O)を設定すべきである。一方、軽度~中等度ARDSでは10㎝H2O未満の低PEEPを安全に使用できる。
酸素化の改善は肺リクルートメントではなく血行動態への効果(心拍出量の減少や右左シャントの減少)によるかもしれない。PEEP設定を行う前に患者の血行動態を安定化しておくべきであり、評価中は血行動態の変動を最小限にすべきである。さらに、肺への過剰なストレスを避けるため、経肺圧をモニタすべきである。
◎ 私見
ARDSに代表される重症低酸素血症に対する呼吸管理戦略について解説してある。自分は少なくともARDSに関してはNIVはあまり期待できないのではないかと思っている。ヘルメット型のインタフェイスがよいのではという報告はあるにはあるけれど。PEEPとリクルートメントについては、肺エコーと食道内圧に注目。食道内圧、測ってみたいな。
ここ数十年でPEEPの哲学は変化した。人工呼吸の歴史の始まりにおいては酸素化を改善する単純なツールであったものが、ここ数年で肺保護換気の枠組みにおいて、換気サイクル中の肺胞の開放・虚脱を避けて肺領域が不均質となるのを抑止するという役割を担うとみなされるようになった。肺水腫の程度によってリクルート可能な肺容量は0~70%と様々になる。患者移送とX線被曝の問題があるもののCTがその評価のゴールドスタンダードである。低線量プロトコルを用いた肺リクルートメントの視覚的評価は有用と思われる。さらに、CTによって約半数の患者の診断に寄与して治療方針を変えたとする報告もある。代替手段としては肺エコーの正確性が高いとされるが、さらなる研究が必要である。
いくつかの実験的研究や観察研究では、ARDSに対して高PEEPが有用であることを報告しているものの、無作為化試験(ALVEOLI、EXPRESS、LOV)では低PEEPと高PEEPで予後に有意差は認められなかった。しかし、重症患者群(P/F<200)のみに対象を絞ってメタ解析すると、高PEEPは死亡率を減らすことが分かった。つまり、重症度が高い(肺水腫の程度が強い)ほどPEEPのVILI減少効果が大きくなることを示している。リクルート可能な領域が大きい患者でのみ高PEEPは肺胞開放・虚脱サイクルを抑制できるとする近年の観察研究結果とも合致する。しかし、Cressoniらは肺の開放を維持するPEEPレベルとリクルートメント可能な肺領域の程度とは関係がないことを示し、肺水腫の程度とリクルートメント効果との相関関係に疑義を呈している。これらのことを合わせて考えると、肺水腫の程度だけでなく、発症からの時間、病変の分布などにもリクルートメントの効果は影響を受けるといえるだろう。
PEEPの調節にはいくつかの方法がある。一般的なのはPEEP/FIO2表を用いる方法である。他には、換気メカニクスに基づき、一回換気量を一定にして気道内圧が安全域を超えないように(26~28㎝H2O)PEEPを上昇させたり、RMの後にコンプライアンスを見ながらPEEPを減らす方法などがある。呼気終末の食道内圧が胸腔内圧を正確に反映するかどうかはよくわかっていないが、Talmorらは呼気終末の経肺圧が0~10㎝H2OとなるようにPEEPを設定すると、酸素化や肺コンプライアンスが改善することを報告している(絶対値法)。PEEPや一回換気量による食道内圧の変化から吸気終末の経肺圧を計算する方法もある(エラスタンス法)。Grassoらはこの方法を用いることで、通常の気道内圧を用いる方法に比べて酸素化を改善し、ECMOを避けることができたと報告している。しかし、この両者(絶対値法とエラスタンス法)を比較したところ、結果として得られた推奨PEEPの値にはばらつきが大きく、30%の症例ではPEEP変化の方向が逆になったとされている。
ガス交換、換気メカニクス、経肺圧に基づくPEEP設定と、リクルートメント可能な肺領域の量、重症度を比較したところ、ガス交換を参考にする方法(LOV試験のFIO2/PEEP表)のみが重症度に応じたPEEP設定となった一方、ほかの方法(換気メカニクス、経肺圧を参考する方法)ではほぼ同等のPEEPレベルとなり、これは患者の重症度やリクルート可能な肺領域の量とは相関しなかった。興味深いのは、肥満患者においては肺の含気は非肥満患者に比べて小さいものの、リクルートメントの効果や胸壁エラスタンスはほぼ同等であったことである。
現時点のデータを参照する限り、完璧なPEEP(酸素化、コンプライアンス、VILI減少効果が最大になるPEEP)は存在しないと言わざるを得ない。よって、急性期ではPEEPを決める前にARDSの重症度を層別化することから始める。これはPEEP 5㎝H2Oで淳酸素を用いて換気することで容易に行える。重度ARDSではリクルートメント可能な肺容量ををCTや肺エコーを用いて計算し、LOV試験のPEEP/FIO2表を用いて高PEEP(>15㎝H2O)を設定すべきである。一方、軽度~中等度ARDSでは10㎝H2O未満の低PEEPを安全に使用できる。
酸素化の改善は肺リクルートメントではなく血行動態への効果(心拍出量の減少や右左シャントの減少)によるかもしれない。PEEP設定を行う前に患者の血行動態を安定化しておくべきであり、評価中は血行動態の変動を最小限にすべきである。さらに、肺への過剰なストレスを避けるため、経肺圧をモニタすべきである。
◎ 私見
ARDSに代表される重症低酸素血症に対する呼吸管理戦略について解説してある。自分は少なくともARDSに関してはNIVはあまり期待できないのではないかと思っている。ヘルメット型のインタフェイスがよいのではという報告はあるにはあるけれど。PEEPとリクルートメントについては、肺エコーと食道内圧に注目。食道内圧、測ってみたいな。
2016年6月16日木曜日
末梢循環の状態から臓器灌流を推測できるか
Changes in peripheral perfusion relate to visceral organ perfusion in early septic shock: A pilot study
Andreas Brunauer, et al
Andreas Brunauer, et al
J Crit Care 2016;35:105-109
✔ 背景
重症敗血症・敗血症性ショックでは大循環のパラメータは微小循環の状態とほとんど相関しないことが知られている。末梢循環を評価する身体所見が臓器灌流と相関するかどうかを検討した
✔ 方法
単施設前向きパイロット研究。連続した30例の重症敗血症・敗血症性ショックを対象とした。毛細血管再充満時間(CRT)、斑状皮膚スコア(Mottling score; MS)、触診で評価した末梢温(Peripheral temperature; PT)を入室24、48、72時間目に評価した。同時に、ドプラエコーを用いて肝臓、脾臓、腎臓、小腸の灌流をPerfusion index(PI)で評価した。
✔ 結果
CRT、MS、PTは相互に強い相関を示した。同様に各臓器のPIも相互に強い相関を示した。CRTは小腸のPIと、MSは腎臓のPIと有意に相関したが、PTはどの臓器のPIとも相関しなかった。時間経過に伴う各末梢循環指標の推移と臓器PIの推移を比較したところ、CRTと肝臓・小腸のPIの推移が、また、MSと腎臓のPIの推移が有意に関連していたが、PTはやはりどの臓器とも関係しなかった。
✔ 結論
CRTとMSは敗血症性ショック早期の臓器PIと相関する可能性がある。
◎ 私見
パイロット研究なので結論は出せないが、身体所見で臓器の灌流状態を推測できるとするというのは興味深い。消化器の状態を知るために指を触り(CRT)、腎臓の状態を知るために脚を見る(MS)。末梢温は主観による「温かい」「冷たい」の2分類しかないので、このパイロット研究では有意差が出なかっただけの可能性もあり、今後の研究では何らかの有意義な所見となる可能性もある。ベッドサイドに行ったらまず手と足を触ることにしている(もちろん意識のある人では声もかけますが)自分としては、とても気になる研究でした。
2016年6月13日月曜日
輸液反応性はエビデンスに基づいているか
Is the concept of fluid responsiveness evidence-based?
Saleh AS.
Intensive Care Med. 2016 Jul;42(7):1187-8. PMID: 27143023
Saleh AS.
Intensive Care Med. 2016 Jul;42(7):1187-8. PMID: 27143023
✔ 近年発表された二つのメタアナリシスで、MonnetらはPassive leg raising(PLR)は輸液反応性の正確な指標と報告し、EskesenらはCVPは輸液反応性を反映しないと報告している。ここ30年ほど全盛となっている輸液反応性は、輸液治療における聖杯(至高の目標)であり、モニタはこれを正確に評価できるかどうかという点において有用性を判定されてきた。しかし驚くべきことに、輸液反応性の生理学的前提を支持する臨床的エビデンスはない。
前負荷と心拍出量に関するFrank-Starling曲線に基づき、輸液反応性は輸液負荷によって10~15%心拍出量が増加することと定義されている。しかし、そもそもFrankの原著では単離したカエルの単心室を用いた観察であり、一方、ヒトは二つのそれぞれ異なる特性を持った心室が様々な後負荷や収縮力をもって心拍出量が規定されている。つまり、様々な個人の様々な状況下における様々な心拍出量の変化の割合にどのような意義があるのかと考えなければならない。例えば、健康な脱水のないボランティアではPLRに対して、心拍出量変化のばらつきが大きく(-12%~19%)、10%以上心拍出量が増えたものは45%存在した(輸液反応性あり!)という報告がある。
Monnetらの報告の”輸液負荷を行う唯一の理由は心拍出量を増やすことである”という序文には、近年のショック状態における大循環と微小循環の矛盾の観点から異議がある。輸液負荷によって微小循環が改善すれば、心拍出量の変化とは関係なく臓器灌流不全も改善すると報告されている。また全身の血行動態とは無関係に輸液が腎血流量を変化させることも報告されている。
Eskesenらは”輸液過剰が死亡率を上昇させるため輸液反応性のある症例とない症例を明確に区別することは重要である”と述べている。注意すべきは、輸液反応性のない患者に輸液をすることは有害であっても、輸液反応性を利用することで輸液過剰を減らせたとする臨床的証拠はないことである。輸液負荷によって増加した心拍出量は90分後には元に戻る、という近年の報告からもわかる通り、心拍出量を増やしておくためには繰り返し輸液を負荷しなくてはならず、これにより輸液量は多くなる。FACTT研究の後ろ向き解析によると、無作為化の前までの水分バランスは4.5Lほどであり、23%の症例が輸液反応性ありと判定されていたが、輸液反応性の有無と予後には有意な関係はなかったとのことである。
Monnetらの報告でもPLRや輸液反応性は生存率を有意に改善させていない。しかし、”これは診断学的ツールであり、予後を変化させないからといって有用ではないとは言えない”としている。これには賛成できない。診断的ツールを使おうとするとき、臨床医はその正確度だけを考えるのではなく、その臨床的有用性、使いやすさ、コストを考えるのである。臨床的有用性とは、診断的検査によって、患者予後を改善させるために引き続き行われる介入をどのように変化させればよいのかという情報が提供されることであり、輸液反応性においては輸液をするかしないかという点である。
輸液反応性検査ではコストのかかる心拍出量測定機器や超音波検査の専門家が必要であり、どこでも利用できるわけではない。これをゴールドスタンダードとする前に乳酸クリアランスや輸液耐性、血圧などのような簡単な指標と比べて予後を改善するかどうかということを検証したエビデンスが必要である。
Eskesenらは”輸液過剰が死亡率を上昇させるため輸液反応性のある症例とない症例を明確に区別することは重要である”と述べている。注意すべきは、輸液反応性のない患者に輸液をすることは有害であっても、輸液反応性を利用することで輸液過剰を減らせたとする臨床的証拠はないことである。輸液負荷によって増加した心拍出量は90分後には元に戻る、という近年の報告からもわかる通り、心拍出量を増やしておくためには繰り返し輸液を負荷しなくてはならず、これにより輸液量は多くなる。FACTT研究の後ろ向き解析によると、無作為化の前までの水分バランスは4.5Lほどであり、23%の症例が輸液反応性ありと判定されていたが、輸液反応性の有無と予後には有意な関係はなかったとのことである。
Monnetらの報告でもPLRや輸液反応性は生存率を有意に改善させていない。しかし、”これは診断学的ツールであり、予後を変化させないからといって有用ではないとは言えない”としている。これには賛成できない。診断的ツールを使おうとするとき、臨床医はその正確度だけを考えるのではなく、その臨床的有用性、使いやすさ、コストを考えるのである。臨床的有用性とは、診断的検査によって、患者予後を改善させるために引き続き行われる介入をどのように変化させればよいのかという情報が提供されることであり、輸液反応性においては輸液をするかしないかという点である。
輸液反応性検査ではコストのかかる心拍出量測定機器や超音波検査の専門家が必要であり、どこでも利用できるわけではない。これをゴールドスタンダードとする前に乳酸クリアランスや輸液耐性、血圧などのような簡単な指標と比べて予後を改善するかどうかということを検証したエビデンスが必要である。
◎ 私見
輸液反応性は大流行だが、臨床的に有用だとする証拠はまだそろっていないという意見。ちなみに、このCorrespondenceにはCVPに関するメタアナリシスを行ったEskessenらの論文の共著者であるPerner先生から返事があって、そこには「仰ることはごもっとも。でも、我々の研究はあくまで”輸液反応性”の文脈でのみ見てね」という趣旨のことが書いてある。
2016年6月10日金曜日
敗血症にはビタミンS(ステロイド)とビタミンC
"Vitamin S" (Steroids) and Vitamin C for the Treatment of Severe Sepsis and Septic Shock!
Marik PE.
Crit Care Med. 2016 Jun;44(6):1228-9. PMID: 27182850
Marik PE.
Crit Care Med. 2016 Jun;44(6):1228-9. PMID: 27182850
✔ 重症敗血症や敗血症性ショックは免疫反応の不均衡によって起きると考えられている。NF-κβの過剰な活性化により”サイトカインの嵐”が敗血症早期で生じる。糖質コルチコイドは様々な遺伝的・非遺伝的機序を通じてNF-κβを抑制することから、内因性糖質コルチコイドによるNF-κβの調整がうまくいかなくなることで敗血症早期の免疫不均衡が生じると考えられる。コルチゾルの分泌不全(相対的副腎不全)や糖質コルチコイドに対する組織の反応性の低下が糖質コルチコイド活性低下の原因であると推測されており、Critical illness related corticosteroid insufficiency(CIRCI)という概念が提唱されるに至った(これをビタミンS欠乏ともいう)。CIRCIには様々な病態学的機序が関与している。敗血症性ショックにおいて、副腎細胞はACTHに対する反応性を失う可能性がある。IL10のような抗炎症サイトカインは副腎におけるステイロイド新生を抑制する。基質(高濃度リポ蛋白)の欠乏は不適切なコルチゾル新生を起こす。さらに、ACTH受容体の多型性によりストレスに対するコルチゾル反応性が低下する可能性もある。組織における糖質コルチコイド反応性低下は慢性炎症疾患ではよく知られた現象である。敗血症や急性肺障害のような急性疾患でも、糖質コルチコイド耐性を呈する可能性がある。糖質コルチコイド受容体(GR)の分子学的メカニズムの変化によりシグナル伝達や感受性が変化する。敗血症モデルを用いた研究で、BergquistらはGR-αの発現低下とGR複合体の核内以降を報告している。糖質コルチコイドの抗炎症作用は男性で強い。エストロゲンはGRのリン酸化を阻害して糖質コルチコイドの作用に拮抗すると考えられている。敗血症ではGRのβ-isoform(GR-β)の発現増加が報告されており、GR-βはコルチゾルと結合しないためGR-αに抑制的に作用すると考えられる。
Cohenらは敗血症性ショックにおける糖質コルチコイド感受性を検討した。糖質コルチコイド感受性はin vitroでLPS刺激に対するサイトカイン産生能を測定することで評価した。健常者と敗血症患者で有意差はなかったものの、敗血症群で感受性のばらつきが大きくなっていた。また、感受性が特に低い患者で重症度が高く死亡率も高い傾向があった。GR-βや11β-HSD-2の発現は敗血症群で有意に高かったが、感受性とは相関しなかった。この研究では両群間に有意差を見いだせなかったわけだが、これは測定系の感度が低かったからかもしれない。糖質コルチコイドのNF-κβシグナル伝達に対する抑制作用を代替指標として用いている。GR標的遺伝子の発現を直接計測するほうがより正確だろう。しかし、この研究は敗血症のような急性炎症疾患の早期に糖質コルチコイド耐性が生じうることを示すものである。重要なのは、視床下部-下垂体-副腎の経路を評価する方法では、このような相対的副腎機能不全や糖質コルチコイド耐性を評価できないということである。
実験モデルによる検討で、糖質コルチコイドを投与することで糖質コルチコイド耐性に打ち克つことができることが示されているが、これは時間依存性である。炎症促進反応や抗炎症反応の修飾を抑制することに加え、糖質コルチコイドはアドレナリン感受性を増加させ、内皮細胞の結合を回復し、グリコカリックスを維持するという点でも有益であると考えられる。
敗血症におけるNF-κβのシグナル伝達を抑制するには糖質コルチコイド単独では不十分である。活性酸素種(ROS)もNF-κβの活性化に重要である。サイトカインやLPS刺激でROSは増加するが、抗酸化物質でこれを抑制できる。実験的研究や臨床研究で、大量ビタミンCがNF-κβ活性を抑制し、炎症マーカを減少し、臓器不全も減らすことが知られている。糖質コルチコイドと同様、ビタミンCも内因性ノルアドレナリンやバゾプレシン産生を増加することで血管作動薬の反応性を増加させる。糖質コルチコイドはNa依存性ビタミンC輸送体を増加させて細胞のビタミンC取り込みを増やすので、両者は相乗的に作用すると考えられる。ビタミンCを内服させることでぜんそく患者のステロイド必要量を減らすことができるという報告もある。重症敗血症ないし敗血症性ショックにおいてはステロイド(ビタミンS)とビタミンCを早期に投与することが有用であると考えられる。これを検証するための臨床研究が必要である。
◎ 私見
NF-κβからみたステロイドとビタミンCの可能性を論じたもの。Marik先生らしい文章。ビタミンCか・・・。ClinicalTrilals.govをみると、いくつかのRCTが予定されている様子。
「より重症の敗血症ではこのようなアプローチが有用となりうる」、つまり重症度による層別化の考え方と、「従来の方法では副腎機能不全を評価することにはなりえない」という点は重要。特に重症度による層別化は、今後重要になってくるのではないかと思っている。
実験モデルによる検討で、糖質コルチコイドを投与することで糖質コルチコイド耐性に打ち克つことができることが示されているが、これは時間依存性である。炎症促進反応や抗炎症反応の修飾を抑制することに加え、糖質コルチコイドはアドレナリン感受性を増加させ、内皮細胞の結合を回復し、グリコカリックスを維持するという点でも有益であると考えられる。
敗血症におけるNF-κβのシグナル伝達を抑制するには糖質コルチコイド単独では不十分である。活性酸素種(ROS)もNF-κβの活性化に重要である。サイトカインやLPS刺激でROSは増加するが、抗酸化物質でこれを抑制できる。実験的研究や臨床研究で、大量ビタミンCがNF-κβ活性を抑制し、炎症マーカを減少し、臓器不全も減らすことが知られている。糖質コルチコイドと同様、ビタミンCも内因性ノルアドレナリンやバゾプレシン産生を増加することで血管作動薬の反応性を増加させる。糖質コルチコイドはNa依存性ビタミンC輸送体を増加させて細胞のビタミンC取り込みを増やすので、両者は相乗的に作用すると考えられる。ビタミンCを内服させることでぜんそく患者のステロイド必要量を減らすことができるという報告もある。重症敗血症ないし敗血症性ショックにおいてはステロイド(ビタミンS)とビタミンCを早期に投与することが有用であると考えられる。これを検証するための臨床研究が必要である。
◎ 私見
NF-κβからみたステロイドとビタミンCの可能性を論じたもの。Marik先生らしい文章。ビタミンCか・・・。ClinicalTrilals.govをみると、いくつかのRCTが予定されている様子。
「より重症の敗血症ではこのようなアプローチが有用となりうる」、つまり重症度による層別化の考え方と、「従来の方法では副腎機能不全を評価することにはなりえない」という点は重要。特に重症度による層別化は、今後重要になってくるのではないかと思っている。
2016年6月7日火曜日
このAKIに腎代替療法は必要?
Does this patient with AKI need RRT?
Schetz M, Forni LG, Joannidis M.
Intensive Care Med. 2016 Jul;42(7):1155-8. PMID: 26690077
Schetz M, Forni LG, Joannidis M.
Intensive Care Med. 2016 Jul;42(7):1155-8. PMID: 26690077
✔ 症例
右上葉切除術後5日目の65歳の患者が乏尿+低血圧となりICUに入室した(0.17ml/kg/hr×24hrs、AKI stage 3)。クレアチニンはベースラインである1.36㎎/dlから3.78mg/dlに上昇(AKI stage 2)。イレウスとなり嘔吐している。CRPが上昇したので抗菌薬が投与されている。術後の内服薬はACE阻害薬、NSAIDsである。ICU入室後に輸液を投与し、ノルアドレナリン(0.15㎎/kg/min)と広域抗菌薬を投与した。翌朝、クレアチニンは4.53㎎/dl(AKI stage 3)となっており、尿量は過去12時間が0.1ml/kg/hと減少しており、輸液バランスはプラス3300mlとなっていた。動脈血液ガスではpH 7.39、PaO2 87、Bicarbonate 25、K 3.9、Urea 128であった。酸素2Lを吸入し呼吸数は20回、胸部X線写真で両側に浸潤影と切除した部位に胸水を認めている。この患者に腎代替療法(RRT)は必要か?
1.RRTを直ちに開始すべき絶対的な適応があるか?
一般的に受け入れられている緊急RRTの古典的適応は、輸液過剰、電解質・酸塩基平衡異常、重症尿毒症(脳症や心外膜炎合併例)であるが、これらの閾値は決まっていない。本症例ではこれらの適応は生じていない。
2.古典的適応が生じるまで待つべきか/早期にRRTを始めることで予後が改善するか?
過去15年間で3つの小規模なRCTが行われており、死亡率には有意差はないものの適応を待った方が最終的なRRTを17~37%で避けることができたとしている。遅く始める群で実際に古典的適応が生じたのは1/3に過ぎなかった。観察研究では古典的適応が生じてからRRTを始めたほうが予後が良いとするものと、全く反対の結果を示したものがある。いくつかの観察研究は後ろ向きの定義を用いており、これは実際にRRTを開始した根拠とは言えないが、大部分は早期開始の有用性を示している。しかし、これらの研究はバイアスが大きいことに注意しなくてはならない。すなわち、RRTを用いない対照群が存在せず、多くの症例(特に早期群)で不必要なRRTを受ける可能性があることである。近年のRRTを要さなかった患者を含めた研究では傾向分析スコアを用いた解析でRRTは予後を悪化させることを示した。VaaraらはPre-emptive RRTの有用性を報告しているが、傾向スコアでマッチさせることのできた省令は非常に少なかった。
3.敗血症はRRTを早く始める理由になるか?
理論的にはRRTは炎症性メディエータを除去することができるため、敗血症は早期RRTの適応となりえると考える医師もいる。しかし、臨床データの裏付けはない。重症敗血症を対象にCVVHと標準的治療を比較したRCTではCVVH群で予後が悪化した。
4.全体的管理の助け(臓器支持療法の考え方)となるか?
もしくは、RRTをしないことで、例えば経腸栄養や薬剤/抗菌薬投与が輸液過剰のために適切に行えなくなるかと考えればわかりやすい。実際、利尿薬に反応しない乏尿を呈している場合、輸液過剰がしばしばRRTの適応となっている。輸液過剰と予後悪化の関係は疑いようがないのに対し、両者の因果関係まではまだわかっていない。早期RRTによる輸液過剰の予防ないし改善の有用性を証明した前向き研究は存在しておらず、重症患者で早期から水分量を管理することの有用性は不明である。しかし、ある患者群(ARDSやうっ血性心不全)では水分管理によって輸液過剰を避けることが有用であると報告されている。腎機能改善を見込めるかということ以外にも、輸液過剰に対する耐用性も重要な因子であると考えられる。
5.腎機能改善が見込めるか?
AKIの早期でRRTが必要となるかどうかは予測できないが、ループ利尿薬への反応をみることはバイオマーカよりは有用かもしれない。実臨床においては腎機能の推移や腎臓以外の因子(重症度、疾患改善までの時間)が非常に有用である。
6.不必要なRRTによる有害性とRRTが遅れることによる有害性の比較
まず害を与えないこと。AKIは独立した予後悪化予測因子であるという事実が早期RRT開始が予後に影響するのではないかという考え方を助長している。AKIは全身性に多くの影響を及ぼしているが、RRTはその一部しか補正しない。RRTを積極的に行っても予後は改善せず不必要なRRTを害悪を与えることなく行うこともできない。RRTは低血圧を起こしうるし、必要な基質(栄養や薬剤)を除去し、電解質バランスを変化させて不整脈の原因となり、抗凝固薬による出血、不均衡症候群、感染症、機械的合併症、低体温、生体不適合、輸液バランスの間違い、コストなどが問題となる。
7.無益な治療となるのであればRRTは行わない
✔ 症例のその後
本症例は病前の状態は健康であった。手術は治療的なものであったため、RRTを始めることは適当である(治療の差し控えを考えなければいけない状態ではない、ということ)。古典的適応は生じていないが、乏尿であり、酸素化は正常である。最近まで腎機能を悪化させうる薬剤(NSAIDs、ACE-I)を内服しており、このAKIは少なくとも部分的には輸液反応性がありそうである(イレウスと嘔吐)。結局、RRTは開始しなかった。翌日、クレアチニンは5.2まで上昇したがその後は改善した。
◎ 私見
RRTを始めるかどうかを考えるとき、どんなポイントを押さえておけばよいのかということが示されている。症例ベースなので、研修医とディスカッションするのにも使えそう。
RRT開始のタイミングに関する研究(AKIKI; NEJM、ELAIN; JAMA)が発表され、敗血症性ショックを対象としたIDEAL-ICU studyも進行中。いまのところはNEJMに掲載されたAKIKIがもっとも信用できそう。
2016年6月4日土曜日
敗血症性DICにATⅢは無効か
Is antithrombin III for sepsis-associated disseminated intravascular coagulation really ineffective?
Iba T, Thachil J.
Intensive Care Med. 2016 Jul;42(7):1193-4. PMID: 27143022
Iba T, Thachil J.
Intensive Care Med. 2016 Jul;42(7):1193-4. PMID: 27143022
✔ Allingstrupらは重症患者に対するATⅢの効果に関するシステマチックレビューを報告した。彼らは敗血症だけでなく、敗血症性DICにも的を絞っている。バイアスの小さい4つのRCTを用いたメタアナリシスでATⅢは敗血症ならびに敗血症性DICの予後を改善しないと結論づけた。一方、Umemuraらは同様のメタアナリシスを3つのRCTで行い、ATⅢが死亡率を有意に減らすと結論づけている。なぜこのような違いが生じるのだろうか。両分析に含まれる最も大きな臨床研究はKyberSept試験である。Allingstrupらはこの研究の全症例を解析したが、UmemuraらはDICを合併しヘパリンを投与されていないものを抽出している。Kienastらの報告によるとKyberSeptに参加した2314例のうち、563例がヘパリンを使用しておらず、このうち40.7%(229例)がDICを合併していたと信頼するに足るデータがある。確かに無作為化されているとは言えないが、114例がATⅢを投与され、115例がプラセボを投与されており、ATⅢを投与された群のほうが死亡率が低かった(22.2% vs 40.0%、P<0.01)。
出血はDICをもともと合併していない症例においてATⅢ製剤を投与された群で有意に多かった(9.8% vs 3.1%)が、DICを合併している症例においては両群間に有意差はなかった。Tagamiらは日本における大規模データベースを利用した研究で、ATⅢの低用量投与が28日死亡率を有意に下げることを報告している。このような研究は実臨床におけるATⅢの効果を真に示すものではないかと考えられる。敗血症性DICにおけるATⅢ製剤の効果については結論はだせず、大規模なRCTが必要である。
◎ 私見
臨床研究やReviewだけでなく、EditorialやCorrespondeceも読むようにしている。今回は、ATⅢ製剤に関するAllingstrupらのメタアナリシスに対するコメント。
自分は「ATⅢは足りなければ補う」というスタンス。凝固と炎症は密接にかかわっている(というより、コインの表と裏の関係)なので、凝固に作用する薬剤は炎症にも何らかの作用を及ぼすと考えるのが自然だと思っているが、かといって無闇に投与するのも考えもの。
薬剤を投与する場合、①重症度/緊急度を加味した適応、②タイミング、③投与方法/投与量、④効果判定、⑤合併症/相互作用、⑥コストといった点を考えなければならない。DIC治療薬とされる薬剤では、①、②、③、⑤のあたりがまだ整理されていないと感じている。
自分は「ATⅢは足りなければ補う」というスタンス。凝固と炎症は密接にかかわっている(というより、コインの表と裏の関係)なので、凝固に作用する薬剤は炎症にも何らかの作用を及ぼすと考えるのが自然だと思っているが、かといって無闇に投与するのも考えもの。
薬剤を投与する場合、①重症度/緊急度を加味した適応、②タイミング、③投与方法/投与量、④効果判定、⑤合併症/相互作用、⑥コストといった点を考えなければならない。DIC治療薬とされる薬剤では、①、②、③、⑤のあたりがまだ整理されていないと感じている。
2016年6月1日水曜日
β遮断すべきか否か
To beta block or not to beta block; that is the question.
Ince C.
Crit Care. 2015 Sep 24;19(1):339. PMID: 26400614
Ince C.
Crit Care. 2015 Sep 24;19(1):339. PMID: 26400614
✔ 敗血症は管理が難しいが、これはその病態生理が完全には解明されていないからである。敗血症は過剰な炎症とそれに引き続く心血管系の異常により細胞機能が低下し、臓器不全に陥るという特徴がある。病因は速やかに変化していくだけでなく、通常のモニタでは微小循環や細胞の状態を知ることはできず全身の血行動態を評価するにすぎないため、状態を把握することが困難である。新しいモニタが開発されれば、新しい治療を探索することの助けになるだろう。
Jacquet-Lagrezeらは敗血症モデルを用いた研究で短時間作用型のβ遮断薬であるエスモロールが舌下ないし腸管の微小循環を改善することを示した。心拍数減少とアドレナリン過剰による弊害を遮断するという理論的背景があるが、どのようなメカニズムで利益をもたらしたのかという点がはっきりしない。Morelliらは血行動態や炎症、代謝、凝固などに様々な効果があるのではないかとしている。β遮断薬のもっとも明らかな利点は心拍数を減らして拡張期時間を延ばし、一回拍出量を維持ないし改善することである。しかし、多くの研究が心拍数減少効果を示しているにもかかわらず、心血管系に与える効果に関しては結果が一貫していない。Morelliらは心拍数が減少した患者では一回拍出量が増加したと考えられることを報告した。しかし、引き続いて行われた研究では舌下微小循環は改善しているものの一回拍出量は増えていないという結果であった。Aboabらは敗血症モデルを用いた研究で、エスモロールは一回拍出量の増加と心拍数の減少をもたらすことを示した。しかし、Jacquet-Lagrezeらの研究では心拍数減少効果が見られたにもかかわらず一回拍出量は増えていない。つまり、エスモロールが敗血症患者の血行動態にどのような影響を与えるのかはよくわからないといえそうである。しかし、重症患者にみられる頻脈は予後を悪化させるため、β遮断薬などでこれを減らすことには魅力がある。実際、530人のICU患者を対象とした多施設国際研究では頻脈は単独で最も感度の高い予後悪化予測因子であった。頻脈に加えて微小循環障害の兆候がある場合は、さらに80%予後が悪化した。
Jacquet-Lagrezeらの研究では敗血症モデルを肺動脈圧を指標として菌を注入することで作成している。この方法では体血圧や代謝のパラメータをほとんど変えないため、正常血圧の敗血症モデルということになる。このような正常な体血圧と血行動態パラメータを示しつつ舌下微小循環障害と腸管循環障害を呈する状況は、いくつかの臨床研究でも実際にあり得ることが示されており、合併症や死亡率が高くなることも報告されている。エスモロールがわずかながらも微小循環を改善することは示されたが、正常になっているわけではない。血行動態パラメータが正常範囲内で心拍数を減らしても微小循環が改善するわけではないことが示唆されている。にもかかわらず、「エスモロールは循環に負の効果をもたらすが微小循環を維持する」と結論づけているのは驚きである。エスモロールは心拍数を減らすが、微小循環障害を伴う正常血圧の敗血症モデルでは有益性を証明できなかったするべきではないか。腸管循環に関してもそうである。有意ではないものの腸管の微小循環が改善する傾向があったとしているが、血流の再分布で説明ができる。腸間膜動脈の血流を計測すればよい。エスモロール群でミルリノンの使用が多いことでも説明できる。ミルリノンを除外して検討すべきである。調査されてはいないが、腸管微小循環の改善傾向はエスモロールの抗炎症効果によるものかもしれない。また、舌下微小循環が改善しきっていない点は、これが予後悪化の因子であることを鑑みると、この敗血症モデルの最終的な予後は心配であると言わざるを得ない。ではあるものの、敗血症においてβ遮断を行うことが有用かどうかはまだわからない。
◎ 私見
Jacquet-Lagrezeらの研究に対する厳しめのコメント。β遮断薬は魅力的な薬剤だが、いったい何が真に有益な効果をもたらしているのかがわからないのが問題。心拍数だけでは説明がつかないとは言えそうだが。なので、現時点ではいわゆる「敗血症」に投与するのは適当ではないだろう。ある特定の状況下(たとえば頻脈や高炎症状態)で効果を測定するような研究が必要なのだと思う。
2016年5月28日土曜日
第63回麻酔科学会
急性期医療にかかわる内容を一通りチェック。それよりも気になるのは新専門医制度。来年から始まるわけだが、なんとなく準備不足の感が否めない。単位認定のある講演の入退室も管理されていて、学会の雰囲気そのものが少し変わったような気がした。しかし、あの長蛇の列はどうにかならないものだろうか・・・
2016年5月24日火曜日
胸骨圧迫フィードバック装置は有用
Effect of the Cardio First Angel device on CPR indices: a rondomized controlled clinical trial
Amir Vahedian-Azimi et al
Crit Care 2016;20:147
✔ 背景
胸骨圧迫の質と持続性を改善するために多くの心肺蘇生補助器具が開発されてきた。CPRフィードバック装置がCPRの質を改善し、患者予後を変えるかどうかを検討した。
✔ 方法
4つの大学病院の混合ICUで行われた無作為化試験。心肺停止状態になった患者を通常のCPRを行う群とフィードバック装置(Cardio FIrst Angel)を使用する群とに割り付けた。ガイドライン適合性、CPRの質、自己循環再開率、CPR関連合併症発生率を調査した。
✔ 結果
229例が無作為化されたが149例が除外され、80例が解析対象となった。フィードバック装置を用いると、ガイドライン適合性が有意に改善し、自己循環再開率も高くなった(72% vs 35%)。合併症については、肋骨骨折が有意に減ったが(57% vs 85%)、胸骨骨折の減少効果は有意ではなかった(5% vs 17%)。
✔ 結論
フィードバック装置を用いることでガイドライン適合性が高まり、患者予後が改善する。この結果が他の状況でも再現できるかどうか、検証が必要である。
◎ 私見
CPRの質が重要であることは論を待たないが、実際の現場でそれを達成することは実は難しい。そこで、フィードバック装置を用いて質の管理をするとどうか、という研究。結果は「ものすごく有用」ということになったが、ICUという特殊な状況下での患者を対象としていること、盲検化できないことなどの問題がある。胸骨圧迫装置との比較もみてみたいところ。
Amir Vahedian-Azimi et al
Crit Care 2016;20:147
✔ 背景
胸骨圧迫の質と持続性を改善するために多くの心肺蘇生補助器具が開発されてきた。CPRフィードバック装置がCPRの質を改善し、患者予後を変えるかどうかを検討した。
✔ 方法
4つの大学病院の混合ICUで行われた無作為化試験。心肺停止状態になった患者を通常のCPRを行う群とフィードバック装置(Cardio FIrst Angel)を使用する群とに割り付けた。ガイドライン適合性、CPRの質、自己循環再開率、CPR関連合併症発生率を調査した。
✔ 結果
229例が無作為化されたが149例が除外され、80例が解析対象となった。フィードバック装置を用いると、ガイドライン適合性が有意に改善し、自己循環再開率も高くなった(72% vs 35%)。合併症については、肋骨骨折が有意に減ったが(57% vs 85%)、胸骨骨折の減少効果は有意ではなかった(5% vs 17%)。
✔ 結論
フィードバック装置を用いることでガイドライン適合性が高まり、患者予後が改善する。この結果が他の状況でも再現できるかどうか、検証が必要である。
◎ 私見
CPRの質が重要であることは論を待たないが、実際の現場でそれを達成することは実は難しい。そこで、フィードバック装置を用いて質の管理をするとどうか、という研究。結果は「ものすごく有用」ということになったが、ICUという特殊な状況下での患者を対象としていること、盲検化できないことなどの問題がある。胸骨圧迫装置との比較もみてみたいところ。
2016年5月21日土曜日
腎代替療法を開始するタイミング(AKIKI study)
Initiation strategies for renal-replacement therapy in the intensive care unit
Stephane G, Daved H, Frederique S et al
N Engl J Med. 2016
✔ 背景
生命に直接危険を及ぼさない程度の急性腎傷害に対して、腎代替療法どの時期に始めればよいのかはまだ分かっていない。
✔ 方法
多施設無作為化試験。人工呼吸管理ないしカテコラミン投与をうけており、かつ生命に直接危険を及ぼすような合併症をきたしていないKDIGO分類でStage 3の急性腎傷害患者を対象とした。早期群は無作為化直後に腎代替療法を導入した。晩期群は、高カリウム血症(>6mEq/L)、代謝性アシドーシス(pH<7.15)、肺水腫、BUN>112、72時間以上の乏尿のうち少なくともどれか一つを認めるまで腎代替療法導入を見送った。両群とも、自尿が500ml/dayを超えたときに腎代替療法中止を考慮し、利尿剤を使用せずに1000ml/dayもしくは利尿剤を使用せずに2000ml/dayを超えたときは中止を強く推奨した。プライマリアウトカムは60日生存率とした。
✔ 結果
620人が無作為化された。Kaplan-Meier曲線の分析からは両群間で60日生存率に有意な差はみられなかった。(早期群311例中150例が死亡、晩期群308例中153例が死亡)。晩期群のうち151例は腎代替療法を要さなかった。血流感染の率は早期群で有意に高かった(10% vs 5%, P=0.03)。利尿、腎機能の改善は晩期群でより早く認められた。
✔ 結論
腎代替療法開始のタイミングでは生存率に影響しなかった。晩期に開始する戦略をとればかなりの割合の患者で腎代替療法を避けることができる。
◎ 私見
腎代替療法をどのタイミングで始めるかに関して調べた研究。カンファレンスでもよく議論になるところなので結果が出るのが楽しみだった。これまでは「高カリウム血症などの適応が生じたら」腎代替療法を導入するという戦略を用いてきたので、これは本研究の晩期群の戦略とほぼ同じ。ということで、少なくとも自分の診療方針に変更を加える必要はなさそう。
Stephane G, Daved H, Frederique S et al
N Engl J Med. 2016
✔ 背景
生命に直接危険を及ぼさない程度の急性腎傷害に対して、腎代替療法どの時期に始めればよいのかはまだ分かっていない。
✔ 方法
多施設無作為化試験。人工呼吸管理ないしカテコラミン投与をうけており、かつ生命に直接危険を及ぼすような合併症をきたしていないKDIGO分類でStage 3の急性腎傷害患者を対象とした。早期群は無作為化直後に腎代替療法を導入した。晩期群は、高カリウム血症(>6mEq/L)、代謝性アシドーシス(pH<7.15)、肺水腫、BUN>112、72時間以上の乏尿のうち少なくともどれか一つを認めるまで腎代替療法導入を見送った。両群とも、自尿が500ml/dayを超えたときに腎代替療法中止を考慮し、利尿剤を使用せずに1000ml/dayもしくは利尿剤を使用せずに2000ml/dayを超えたときは中止を強く推奨した。プライマリアウトカムは60日生存率とした。
✔ 結果
620人が無作為化された。Kaplan-Meier曲線の分析からは両群間で60日生存率に有意な差はみられなかった。(早期群311例中150例が死亡、晩期群308例中153例が死亡)。晩期群のうち151例は腎代替療法を要さなかった。血流感染の率は早期群で有意に高かった(10% vs 5%, P=0.03)。利尿、腎機能の改善は晩期群でより早く認められた。
✔ 結論
腎代替療法開始のタイミングでは生存率に影響しなかった。晩期に開始する戦略をとればかなりの割合の患者で腎代替療法を避けることができる。
◎ 私見
腎代替療法をどのタイミングで始めるかに関して調べた研究。カンファレンスでもよく議論になるところなので結果が出るのが楽しみだった。これまでは「高カリウム血症などの適応が生じたら」腎代替療法を導入するという戦略を用いてきたので、これは本研究の晩期群の戦略とほぼ同じ。ということで、少なくとも自分の診療方針に変更を加える必要はなさそう。
2016年5月18日水曜日
呼吸仕事量の主観的評価の信頼性
The validity and reliability of the clinical assessment of increased work of breathing in acutely ill patients
Aiman Tulaimat, Aiyub Patel, Mary Wisniewski, Renaud Gueret.
J Crit Care 2016;34:111-115
Aiman Tulaimat, Aiyub Patel, Mary Wisniewski, Renaud Gueret.
J Crit Care 2016;34:111-115
✔ 背景
人工呼吸管理は呼吸仕事量を軽減する目的でしばしば用いられる。呼吸仕事量をベッドサイドで簡便に客観的に測定することはできないので、患者の外観や呼吸窮迫、呼吸努力の増大などの代替指標でをもって判断することになる。そのような主観的評価の信頼性について調査した。
✔ 方法
なんらかの呼吸補助を要した急性疾患患者を対象とした。集中治療に携わる医師がお互いの評価の内容を知ることができないようにし、10秒間で対象患者の呼吸窮迫の程度を観察し呼吸仕事量増大の徴候の有無を評価し、重症度を判定した(無し、軽度、中等度、重度)。各医療者の評価手順は以下の通り。
Step 1:呼吸窮迫の程度を主観的に判定
Step 2:呼吸仕事量増大の11の徴候を判定
Step 3:バイタルサインの測定
✔ 結果
主観的に判定された呼吸窮迫の程度は酸素化、呼吸数、呼吸仕事量増大の徴候のうち9つと相関した。低酸素、頻呼吸、呼吸仕事量増大の11の徴候のうち3つ以上があった場合を検出対象としたとき、中等度~重度の呼吸窮迫の主観的判定の感度は70%、特異度は92%、陽性尤度比は8であった。主観的評価、鼻翼呼吸、斜角筋収縮、喘ぎ呼吸、腹筋収縮のカッパ係数は0.53-0.47、胸鎖乳突筋収縮、気管牽引、シーソー呼吸のカッパ係数は0.36-0.23であった。
✔ 結論
主観による呼吸仕事量の評価はおおむね信頼できる。
◎ 私見
学生や研修医には呼吸仕事量を”視て”評価することの重要性を強調している。その信頼性を検証した研究。いまだに呼吸数を計測したり記録したりしていない病棟がある。呼吸はつらそうじゃない?って聞いても酸素飽和度で回答されたりして。ちょっとどうにかならないだろうか。
2016年5月15日日曜日
ARDSの血行動態管理④
Experts' opinion on management of hemodynamics in ARDS patients: focus on the effects ofmechanical ventilation.
Vieillard-Baron A, Matthay M, Teboul JL, Bein T, Schultz M, Magder S, Marini JJ.
Intensive Care Med. 2016 May;42(5):739-49. PMID: 27038480
✔ ECMO
VV-ECMOは重症ARDSにおける治療抵抗性の低酸素血症や換気に起因する肺障害を避けるために用いられる。酸素化を改善することにより、肺高血圧を改善し右室の負荷を取り除くことができる。VA-ECMOは低酸素を避けるだけでなく治療抵抗性の循環不全を治療するために用いられる。ECCO2RはVV-ECMOやVA-ECMOに比べて少ない血流量とスウィープガス流量を用いて高炭酸ガス血症やアシドーシス、ひいては肺や心臓に負荷の強い換気設定を避けるために用いられる。VV-ECMOは発症から7日以内の重症ARDSで重度の低酸素血症が持続し、支持療法に反応しない場合に適応になる。一方、VA-ECMOはARDSに重度の心原性ショックが合併した場合に使用を考慮する。現時点ではECCO2Rはデータ不足のためARDSには推奨できない。
いずれにしろ、血行動態に与えるリスクを勘案したうえで、専門性や経験、多職種連携が必要になる。ECMO中の血行動態モニタはまだ検討の途上にあるが、観血的動脈圧、心エコー、体外循環血流量が必要である。熱希釈法や動脈圧波形解析によるモニタは推奨されない。輸液バランスが大きくなると予後が悪化することが知られているため、輸液バランスを記録することは重要である。一般鉄器に、血行動態管理においては注意深い輸液と昇圧剤の使用が必要になる。循環血液量減少は静脈を虚脱させ、脱血不良から溶血の原因になる。一方、循環血液量過剰では肺水腫が悪化して予後が悪化する。よって、少量の輸液負荷(250ml)などのバランスを重視した輸液管理や血圧やエコーの所見を繰り返しながら昇圧剤を使用するなどの戦略が必要になる。
ECMO中の血行動態管理における特殊な点は以下のとおりである。まず、全身血管拡張に対して血管収縮薬(ノルアドレナリンなど)を使用し、左室機能不全を認めた場合は強心薬(アドレナリンやレボシメンダン)をを投与、右室機能不全に対しては前負荷を適正化して肺血管拡張薬(プロスタサイクリンなど)やカテコラミン(アドレナリン、ノルアドレナリン)を投与する。早期評価・早期介入が予後を改善する。急性肺性心が原因ならVA-ECMOへの移行を考える。
◎ 私見
ECMOの立ち位置が解説されている。モニタとか管理の原則はわかるのだけど、それを実現することが難しい。型どおりにはいかないので、ベッドサイドから動けなくなることもしばしばある。ECMOに限らず、一部の人の秘術にならないよう、経験を蓄積して共有する工夫が必要なのでしょう。
Vieillard-Baron A, Matthay M, Teboul JL, Bein T, Schultz M, Magder S, Marini JJ.
Intensive Care Med. 2016 May;42(5):739-49. PMID: 27038480
✔ ECMO
VV-ECMOは重症ARDSにおける治療抵抗性の低酸素血症や換気に起因する肺障害を避けるために用いられる。酸素化を改善することにより、肺高血圧を改善し右室の負荷を取り除くことができる。VA-ECMOは低酸素を避けるだけでなく治療抵抗性の循環不全を治療するために用いられる。ECCO2RはVV-ECMOやVA-ECMOに比べて少ない血流量とスウィープガス流量を用いて高炭酸ガス血症やアシドーシス、ひいては肺や心臓に負荷の強い換気設定を避けるために用いられる。VV-ECMOは発症から7日以内の重症ARDSで重度の低酸素血症が持続し、支持療法に反応しない場合に適応になる。一方、VA-ECMOはARDSに重度の心原性ショックが合併した場合に使用を考慮する。現時点ではECCO2Rはデータ不足のためARDSには推奨できない。
いずれにしろ、血行動態に与えるリスクを勘案したうえで、専門性や経験、多職種連携が必要になる。ECMO中の血行動態モニタはまだ検討の途上にあるが、観血的動脈圧、心エコー、体外循環血流量が必要である。熱希釈法や動脈圧波形解析によるモニタは推奨されない。輸液バランスが大きくなると予後が悪化することが知られているため、輸液バランスを記録することは重要である。一般鉄器に、血行動態管理においては注意深い輸液と昇圧剤の使用が必要になる。循環血液量減少は静脈を虚脱させ、脱血不良から溶血の原因になる。一方、循環血液量過剰では肺水腫が悪化して予後が悪化する。よって、少量の輸液負荷(250ml)などのバランスを重視した輸液管理や血圧やエコーの所見を繰り返しながら昇圧剤を使用するなどの戦略が必要になる。
ECMO中の血行動態管理における特殊な点は以下のとおりである。まず、全身血管拡張に対して血管収縮薬(ノルアドレナリンなど)を使用し、左室機能不全を認めた場合は強心薬(アドレナリンやレボシメンダン)をを投与、右室機能不全に対しては前負荷を適正化して肺血管拡張薬(プロスタサイクリンなど)やカテコラミン(アドレナリン、ノルアドレナリン)を投与する。早期評価・早期介入が予後を改善する。急性肺性心が原因ならVA-ECMOへの移行を考える。
 |
| 治療戦略(文献より引用) |
ECMOの立ち位置が解説されている。モニタとか管理の原則はわかるのだけど、それを実現することが難しい。型どおりにはいかないので、ベッドサイドから動けなくなることもしばしばある。ECMOに限らず、一部の人の秘術にならないよう、経験を蓄積して共有する工夫が必要なのでしょう。
2016年5月12日木曜日
ARDSの血行動態管理③
Experts' opinion on management of hemodynamics in ARDS patients: focus on the effects ofmechanical ventilation.
Vieillard-Baron A, Matthay M, Teboul JL, Bein T, Schultz M, Magder S, Marini JJ.
Intensive Care Med. 2016 May;42(5):739-49. PMID: 27038480
✔ 血行動態管理
人工呼吸管理中のARDS患者の管理における最初のステップは組織灌流が適切かどうかを評価することである。血管内容量、つまり前負荷が適切かどうかを調べるためには3つの方法がある。すなわち超音波による下大静脈径の観察、PPV、治療介入によるCVPの変化である。尿量と代謝性アシドーシスも標準的な組織灌流評価法である。輸液蘇生は等張晶質液を用い、ヘモグロビンが8g/dL以下では赤血球輸血も考える。敗血症性ARDSや重度の低アルブミン血症ではアルブミン投与も考慮する。ただし、肺水腫と肺性心を増悪させて酸素化が悪化することがあるので注意深く輸液すべきである。逆に輸液の制限はWest zone 2領域を増やす可能性がある。リスクと利益を注意深く考慮しなくてはならない。組織灌流や酸素化、CVPなど様々なパラメータを考慮しなくてはならないため、輸液反応性をみる単一のアプローチがすべてにおいて正しいということはない。肺血管閉塞による右心不全におけるいくつかの実験的研究により、ノルアドレナリンに比べて過剰輸液は心拍出量、血圧、右心機能を悪化させるとされている。さらに、右心不全は組織灌流を回復されるために投与される輸液の有効性を制限する主因であると報告されている。
ARDSネットワークによるFluid And Catheter Treatment Trial(FACTT)では、血管作動薬を必要としない患者を対象としていたにもかかわらず、多くのARDS患者ではショックが回復していれば輸液を制限した管理が優れていることが示された。輸液制限プロトコルにより人工呼吸管理を必要としない日数が増えたが死亡率には有意な差がなかった。輸液制限プロトコルは複雑なため、ARDSネットワークはショックではないARDS患者に対する単純化した輸液管理を示した。この単純化した輸液管理法はCVPと尿量に基づいて行われ、FACTT-liteと命名された。FACTT-liteとFACTTのプロトコルを比較した試験では同等の非人工呼吸管理日数であった。興味深いことに、FACTT-liteでは新規のショックが少なく、AKIの頻度は同等であった。
次のステップはARDS患者で20~25%に合併するといわれる急性肺性心を見つけることである。肺性心がある場合、優先されるのは右室機能を最適化することである。大事なことなので繰り返すが、さらなる輸液負荷は無効であるばかりでなく有害である。ノルアドレナリンは平均血圧を上昇させて右室からの血液供給を増加させ、有意に右室機能を改善することが報告されている。右室機能(強心作用)と肺循環(血管拡張作用)の両者を併せ持つため、このような状況ではカルシウム感受性改善薬であるレボシメンダンは有用である可能性があるが、この薬剤を使用した試験もある。しかし、低血圧をきたすため、推奨するにはさらなるデータが必要である。
選択的肺血管拡張薬の吸入も治療抵抗性の低酸素血症を呈する患者に用いられる。この薬剤は右室機能も改善すると考えられるが、それを適応としてARDSに使用されたという試験はない。ふたつ薬剤があり、NO(5-10ppm)やプロスタサイクリン(20-30ng/kg/min)が酸素化を改善することが示されているが、予後を改善することは証明されていない。両者とも肺血管抵抗を減少させ、換気血流費を改善するが体血圧は下げないとされる。これらの薬剤は使い始めは有効であってもすぐに効果が減少していくことがある。全身血管の血管拡張薬はARDSにおいて有益性を示せていない。いくつかの研究では抗凝固療法が有用性についてその可能性を報告しているが、臨床研究では有益性を示せていない。実際、活性化プロテインCをARDSに対して用いた第二相試験では有益性を証明できなかった。
血行動態管理の要は、右室への負荷を減らすような呼吸器設定を行うことである。輸液の過負荷は、肺の虚脱、肺の過膨張、低酸素や高炭酸ガス血症による肺血管収縮によって起きる。重度の右心不全は独立した死亡予後の規定因子であるため、心機能に配慮した呼吸管理戦略が行われるべきである。近年、右心不全を助長する4つの危険因子が報告された。肺炎によるARDS、P/F<150、換気駆動圧>18㎝H2O、PaCO2>48mmHgである。すべてが揃うと右心不全のリスクは60%を超え、すべてが無いと10%を下回る。最初の一つの因子を除けば呼吸器設定で調節可能である。リスク因子を避けることが血行動態を適正化し、既に存在する右心機能不全を改善し、予後を改善する助けになる。理想的にはPEEPは肺胞の開通性を維持できると同時に肺循環への悪影響を避けられる設定にすべきである。一方、PEEPは肺の虚脱を避けることで右心系への負荷を減らすために十分なレベルに設定すべきともいえる。豚を用いた研究によると、高PEEP(15㎝H2O以上)を健常肺に適用すると過膨張をきたし、右室の収縮機能を悪化させ、全身の血行動態を悪化させることが示されている。平均気道内圧を上昇させたり肺過膨張をきたすような設定は避けるべきである。これにはHFOVが含まれている。血行動態の観点からも、高度の自発呼吸窮迫も避けるべきである。強い吸気努力は経血管圧を変化させ、肺水腫が形成されやすくなる。肺胞や漏出しやすい血管を覆う間質の圧は胸膜表面で測定された圧と同等であると考えられてきたが、不均質に障害された肺ではそうではない。換気圧は胸膜で生じるため、血管にかかる圧も強い自発吸気があると高くなる。
最後に、非同調や振り子現象(Pendelluft)も肺循環と右室機能を悪化させる可能性がある。腹臥位は換気を均質にすることでVILIを減らすと考えられているが、右室負荷を減らす可能性もある。二つの研究で、腹臥位は実際に負荷のかかった右室機能を改善させることが示されている。
◎ 私見
血行動態を実際にどのように管理するかが解説されている。まずは血管内容量を適正化し、その後に右心機能に重点を置いた薬剤投与や人工呼吸器設定をする。この領域にはとても興味があって。たとえば敗血症性ショックのように重篤な循環不全がすでにあるような場合、ARDSを合併したらどのような管理をするとよいのだろうといつも悩んでいた。右心機能に焦点を当てることで、その答えが出そうな気もする。
Vieillard-Baron A, Matthay M, Teboul JL, Bein T, Schultz M, Magder S, Marini JJ.
Intensive Care Med. 2016 May;42(5):739-49. PMID: 27038480
✔ 血行動態管理
人工呼吸管理中のARDS患者の管理における最初のステップは組織灌流が適切かどうかを評価することである。血管内容量、つまり前負荷が適切かどうかを調べるためには3つの方法がある。すなわち超音波による下大静脈径の観察、PPV、治療介入によるCVPの変化である。尿量と代謝性アシドーシスも標準的な組織灌流評価法である。輸液蘇生は等張晶質液を用い、ヘモグロビンが8g/dL以下では赤血球輸血も考える。敗血症性ARDSや重度の低アルブミン血症ではアルブミン投与も考慮する。ただし、肺水腫と肺性心を増悪させて酸素化が悪化することがあるので注意深く輸液すべきである。逆に輸液の制限はWest zone 2領域を増やす可能性がある。リスクと利益を注意深く考慮しなくてはならない。組織灌流や酸素化、CVPなど様々なパラメータを考慮しなくてはならないため、輸液反応性をみる単一のアプローチがすべてにおいて正しいということはない。肺血管閉塞による右心不全におけるいくつかの実験的研究により、ノルアドレナリンに比べて過剰輸液は心拍出量、血圧、右心機能を悪化させるとされている。さらに、右心不全は組織灌流を回復されるために投与される輸液の有効性を制限する主因であると報告されている。
ARDSネットワークによるFluid And Catheter Treatment Trial(FACTT)では、血管作動薬を必要としない患者を対象としていたにもかかわらず、多くのARDS患者ではショックが回復していれば輸液を制限した管理が優れていることが示された。輸液制限プロトコルにより人工呼吸管理を必要としない日数が増えたが死亡率には有意な差がなかった。輸液制限プロトコルは複雑なため、ARDSネットワークはショックではないARDS患者に対する単純化した輸液管理を示した。この単純化した輸液管理法はCVPと尿量に基づいて行われ、FACTT-liteと命名された。FACTT-liteとFACTTのプロトコルを比較した試験では同等の非人工呼吸管理日数であった。興味深いことに、FACTT-liteでは新規のショックが少なく、AKIの頻度は同等であった。
 |
| ARDSの輸液管理(文献より引用) |
選択的肺血管拡張薬の吸入も治療抵抗性の低酸素血症を呈する患者に用いられる。この薬剤は右室機能も改善すると考えられるが、それを適応としてARDSに使用されたという試験はない。ふたつ薬剤があり、NO(5-10ppm)やプロスタサイクリン(20-30ng/kg/min)が酸素化を改善することが示されているが、予後を改善することは証明されていない。両者とも肺血管抵抗を減少させ、換気血流費を改善するが体血圧は下げないとされる。これらの薬剤は使い始めは有効であってもすぐに効果が減少していくことがある。全身血管の血管拡張薬はARDSにおいて有益性を示せていない。いくつかの研究では抗凝固療法が有用性についてその可能性を報告しているが、臨床研究では有益性を示せていない。実際、活性化プロテインCをARDSに対して用いた第二相試験では有益性を証明できなかった。
 |
| ARDSの血行動態管理(文献より引用) |
 |
| 間質の圧と血管内にかかる圧(文献より引用) |
◎ 私見
血行動態を実際にどのように管理するかが解説されている。まずは血管内容量を適正化し、その後に右心機能に重点を置いた薬剤投与や人工呼吸器設定をする。この領域にはとても興味があって。たとえば敗血症性ショックのように重篤な循環不全がすでにあるような場合、ARDSを合併したらどのような管理をするとよいのだろうといつも悩んでいた。右心機能に焦点を当てることで、その答えが出そうな気もする。
2016年5月9日月曜日
ARDSの血行動態管理②
Experts' opinion on management of hemodynamics in ARDS patients: focus on the effects ofmechanical ventilation.
Vieillard-Baron A, Matthay M, Teboul JL, Bein T, Schultz M, Magder S, Marini JJ.
Intensive Care Med. 2016 May;42(5):739-49. PMID: 27038480
✔ VILIと血管系
VILIは肺組織に対する静的・動的ストレスによって生じる。肺胞ではガスと血液は脆弱な膜で隔てられており、換気によって生じた力が十分に高いと血管内の圧や血流そのものがVILIの重症度に影響するようになる。肺水腫により肺サーファクタントは減少し、肺胞の虚脱と開放によるストレスが増加する。実験的には毛細血管前の血圧が高いとVILIの重症度は高くなるが、毛細血管後の血圧を下げても同様の現象が生じる。この原因はよくわかっていないが、West zone 2領域の形成が微小血管内の圧較差を増大させ、ずり応力や血管内皮におけるエネルギー損失を大きくするとする仮説がある。ARDSにおいて心拍出量が増大すると、減少している血管床を通過するために血管内流速が増大することになる。実験的には気道内圧と呼吸数を大きくすることで血流を制限し毛細血管障害を減じることが示されている。逆に気道内圧や血管内圧を変化させないで呼吸数を減らすと障害が減少するという現象も報告されている。含気のある部位だけでなく血管もVILIにおいて重要だとはいえるだろう。この領域の臨床データは少ないが、現時点では、換気と酸素の需要を減らす(呼吸仕事量を減らす)ことに意義があると示唆されている。
✔ 血行動態モニタ
血流とガス交換を改善し、VILIのリスクを最小にするために血行動態のモニタは重要である。観血的動脈圧モニタを用いることで血圧をリアルタイムに測定し、脈圧変動(PPV)を調べることができる。注意深く用いれば、PPVによって輸液反応性を評価できる。すなわち、陽圧換気によって一回拍出量が影響を受けやすいのであれば輸液反応性があるとするのである。しかし、自発吸気努力があったり、低一回換気量の設定になっていたり、低肺コンプライアンスの状態では信頼性が低下する。これらの所見はARDSにおいてよくみられるものである。とはいうものの、低一回換気量や低肺コンプライアンスでもPPVが12~13%を超えていたら輸液反応性があるとしてよい。その場合輸液により心拍出量は増えるがPEEPによっては心拍出量が下がる。重篤な右心不全がある患者では、PPV高値は輸液反応性ではなく右室後負荷依存性を示唆する。このような場合、Passive leg raising(PLR)を行いつつ心エコーで右室機能を評価するべきである。PLRによってPPVが減少するなら輸液反応性があると考えられるが、変化しないのなら右室後負荷依存性の存在を考える。
中心静脈カテーテルはARDS患者に対して心血管作動薬の投与、CVPやScvO2の測定のために挿入されることが多い。CVPは前負荷に対する反応性をほとんど予測しないが、治療に対する右室機能の変化を評価する際には助けになる。食道内圧はPplを推定するために測定されるが、右房の壁内外圧較差(右房圧ーPpl)を計算して、換気が血行動態にどのように影響するかを評価することができるようになる。
心エコーは心室の大きさや機能に関する情報を収集したり、治療に対する心拍出量の変化を評価したり、換気に対する大静脈径の変化を測定したり、PLRのような輸液反応性試験に対する前負荷の適切性を調べるために治療開始の早期に行うべき検査である。多くの場合経胸壁心エコー(TTE)で十分だが、経食道心エコー(TEE)のほうが急性肺性心の評価には有用である。ARDSにおいて、右室拡張末期面積(RVEDA)と左室拡張末期面積(LVEDA)を測定して比較することで右室のサイズを簡単に評価できる。RVEDA/LVEDAが0.6~1.0では中等度の右室拡張があると判定され、1を超える場合は重度の右室拡張があると判定される。急性肺性心はRVEDA/LVEDA>0.6に加えて心室中隔の収縮末期における奇異性運動の存在によって診断される。心エコーを行う際にはLVEF、LVEDA、心拍出量、LV充満圧を測定すべきである。
重度のARDSや敗血症で初期治療に反応しない場合はさらなる血行動態モニタを考えるべきである。このような場合、肺動脈カテーテル(PAC)が有用である。肺動脈圧(PAP)、肺動脈閉塞圧(PAOP)、肺/体血管抵抗を測定できる。高PEEPを用いて人工呼吸管理をしている場合、PAOPの壁内外圧較差を計算することで左室の充満圧を正確に評価できる。PACによって心拍出量や混合静脈血酸素飽和度を測定でき、この二つの指標は重要な治療(PEEP、輸液、薬剤)に対する反応を評価する際に用いられる。右室拡張に伴って三尖弁逆流がある場合、心拍出量測定に誤差が生じる。ARDSでは、特に輸液が多い場合、経肺圧(TP)増大に伴ってWest zone 1と2の領域が異常に拡大している。よって、PVRは真の肺血管抵抗より低く計算されてしまう。その場合は経肺圧較差(平均PAP-PAOP)を肺血管の異常を評価する際に用いることができる。
経肺熱希釈法も用いることができるが、ARDSでは心拍出量よりも肺外水分量や肺血管透過性係数といった指標が重要である。輸液過負荷の害を評価することができる。さらに経肺熱希釈法による心拍出量測定で動脈圧波形解析による心拍出量推定を補正できる。前負荷反応性の指標であるPPVやSVVも用いることができる。しかし、卵円孔開存しているARDS患者では測定値に誤差が生じることが報告されている。多くの侵襲的・非侵襲的波形解析法に基づく心拍出量測定が開発されてきたが、敗血症や大量の血管作動薬を使用している際には信用性が低下する。
◎ 私見
VILIについては換気メカニクスだけでなく血流も考えないといけないこと、ARDSにおける血行動態モニタの使い方について解説してある。右心機能や肺血管抵抗、肺(外)水分量などは今後もっと注目されるようになるのではないだろうか。評価がすんだら治療を、ということで管理方法についての解説に続く。
Vieillard-Baron A, Matthay M, Teboul JL, Bein T, Schultz M, Magder S, Marini JJ.
Intensive Care Med. 2016 May;42(5):739-49. PMID: 27038480
✔ VILIと血管系
VILIは肺組織に対する静的・動的ストレスによって生じる。肺胞ではガスと血液は脆弱な膜で隔てられており、換気によって生じた力が十分に高いと血管内の圧や血流そのものがVILIの重症度に影響するようになる。肺水腫により肺サーファクタントは減少し、肺胞の虚脱と開放によるストレスが増加する。実験的には毛細血管前の血圧が高いとVILIの重症度は高くなるが、毛細血管後の血圧を下げても同様の現象が生じる。この原因はよくわかっていないが、West zone 2領域の形成が微小血管内の圧較差を増大させ、ずり応力や血管内皮におけるエネルギー損失を大きくするとする仮説がある。ARDSにおいて心拍出量が増大すると、減少している血管床を通過するために血管内流速が増大することになる。実験的には気道内圧と呼吸数を大きくすることで血流を制限し毛細血管障害を減じることが示されている。逆に気道内圧や血管内圧を変化させないで呼吸数を減らすと障害が減少するという現象も報告されている。含気のある部位だけでなく血管もVILIにおいて重要だとはいえるだろう。この領域の臨床データは少ないが、現時点では、換気と酸素の需要を減らす(呼吸仕事量を減らす)ことに意義があると示唆されている。
✔ 血行動態モニタ
血流とガス交換を改善し、VILIのリスクを最小にするために血行動態のモニタは重要である。観血的動脈圧モニタを用いることで血圧をリアルタイムに測定し、脈圧変動(PPV)を調べることができる。注意深く用いれば、PPVによって輸液反応性を評価できる。すなわち、陽圧換気によって一回拍出量が影響を受けやすいのであれば輸液反応性があるとするのである。しかし、自発吸気努力があったり、低一回換気量の設定になっていたり、低肺コンプライアンスの状態では信頼性が低下する。これらの所見はARDSにおいてよくみられるものである。とはいうものの、低一回換気量や低肺コンプライアンスでもPPVが12~13%を超えていたら輸液反応性があるとしてよい。その場合輸液により心拍出量は増えるがPEEPによっては心拍出量が下がる。重篤な右心不全がある患者では、PPV高値は輸液反応性ではなく右室後負荷依存性を示唆する。このような場合、Passive leg raising(PLR)を行いつつ心エコーで右室機能を評価するべきである。PLRによってPPVが減少するなら輸液反応性があると考えられるが、変化しないのなら右室後負荷依存性の存在を考える。
中心静脈カテーテルはARDS患者に対して心血管作動薬の投与、CVPやScvO2の測定のために挿入されることが多い。CVPは前負荷に対する反応性をほとんど予測しないが、治療に対する右室機能の変化を評価する際には助けになる。食道内圧はPplを推定するために測定されるが、右房の壁内外圧較差(右房圧ーPpl)を計算して、換気が血行動態にどのように影響するかを評価することができるようになる。
心エコーは心室の大きさや機能に関する情報を収集したり、治療に対する心拍出量の変化を評価したり、換気に対する大静脈径の変化を測定したり、PLRのような輸液反応性試験に対する前負荷の適切性を調べるために治療開始の早期に行うべき検査である。多くの場合経胸壁心エコー(TTE)で十分だが、経食道心エコー(TEE)のほうが急性肺性心の評価には有用である。ARDSにおいて、右室拡張末期面積(RVEDA)と左室拡張末期面積(LVEDA)を測定して比較することで右室のサイズを簡単に評価できる。RVEDA/LVEDAが0.6~1.0では中等度の右室拡張があると判定され、1を超える場合は重度の右室拡張があると判定される。急性肺性心はRVEDA/LVEDA>0.6に加えて心室中隔の収縮末期における奇異性運動の存在によって診断される。心エコーを行う際にはLVEF、LVEDA、心拍出量、LV充満圧を測定すべきである。
重度のARDSや敗血症で初期治療に反応しない場合はさらなる血行動態モニタを考えるべきである。このような場合、肺動脈カテーテル(PAC)が有用である。肺動脈圧(PAP)、肺動脈閉塞圧(PAOP)、肺/体血管抵抗を測定できる。高PEEPを用いて人工呼吸管理をしている場合、PAOPの壁内外圧較差を計算することで左室の充満圧を正確に評価できる。PACによって心拍出量や混合静脈血酸素飽和度を測定でき、この二つの指標は重要な治療(PEEP、輸液、薬剤)に対する反応を評価する際に用いられる。右室拡張に伴って三尖弁逆流がある場合、心拍出量測定に誤差が生じる。ARDSでは、特に輸液が多い場合、経肺圧(TP)増大に伴ってWest zone 1と2の領域が異常に拡大している。よって、PVRは真の肺血管抵抗より低く計算されてしまう。その場合は経肺圧較差(平均PAP-PAOP)を肺血管の異常を評価する際に用いることができる。
経肺熱希釈法も用いることができるが、ARDSでは心拍出量よりも肺外水分量や肺血管透過性係数といった指標が重要である。輸液過負荷の害を評価することができる。さらに経肺熱希釈法による心拍出量測定で動脈圧波形解析による心拍出量推定を補正できる。前負荷反応性の指標であるPPVやSVVも用いることができる。しかし、卵円孔開存しているARDS患者では測定値に誤差が生じることが報告されている。多くの侵襲的・非侵襲的波形解析法に基づく心拍出量測定が開発されてきたが、敗血症や大量の血管作動薬を使用している際には信用性が低下する。
 |
| PPVに基づく血行動態管理(文献より引用) |
VILIについては換気メカニクスだけでなく血流も考えないといけないこと、ARDSにおける血行動態モニタの使い方について解説してある。右心機能や肺血管抵抗、肺(外)水分量などは今後もっと注目されるようになるのではないだろうか。評価がすんだら治療を、ということで管理方法についての解説に続く。
2016年5月6日金曜日
ARDSの血行動態管理①
Experts' opinion on management of hemodynamics in ARDS patients: focus on the effects ofmechanical ventilation.
Vieillard-Baron A, Matthay M, Teboul JL, Bein T, Schultz M, Magder S, Marini JJ.
Intensive Care Med. 2016 May;42(5):739-49. PMID: 27038480
Vieillard-Baron A, Matthay M, Teboul JL, Bein T, Schultz M, Magder S, Marini JJ.
Intensive Care Med. 2016 May;42(5):739-49. PMID: 27038480
✔ 背景
ARDS患者の約6割が循環不全を合併し、約65%で心血管作動薬を要する。循環不全は死亡の原因となりやすく、低酸素を原因とする死亡よりも多い。ARDS患者のショックは以下の三つの因子によって生じる。すなわち、①肺高血圧(肺動脈の微小血栓、リモデリング、低酸素性肺血管収縮、アシドーシス、炎症性メディエータ)、②人工呼吸管理による右心機能不全、③組織需要増大である。
✔ 人工呼吸管理が血行動態に与える影響
胸腔内圧(Ppl)と経肺圧(TP)の変化によって説明される。Pplの変化は右室への血液流入と左室からの拍出に影響する。一方TPの変化は右室からの拍出と左室への血液流入に影響する。Pplの変化が重要である。生体は変化のない大気圧の影響下にあり、肺血管はPplの影響下にあるため、大気圧とPplの差が呼吸サイクルの間に変化することになる。非人工呼吸患者において自発吸気努力によってPplが低下すると、静脈系における圧較差が大きくなるため右室への静脈灌流が増加する。次の数拍動で左室に血液が流入し、吸気終了とともにPplが増加して呼気時に動脈圧が増加することになる。Pplが減少すると心腔内圧は大気圧に比べて相対的に低下し、左室の後負荷は増加する。大きな陰圧吸気努力が繰り返されると、左室後負荷増大と右室充満が生じて肺血流量が増加し、左室機能不全や血管透過性亢進と相まって肺水腫を形成する。
陽圧換気では逆の現象が生じる。陽圧換気によってPplが増大すると左室後負荷は減少するが、同時に静脈灌流量が減るため心拍出量にはほとんど影響しない。右心系の上流にある静脈系からの圧較差は4~8㎜Hgしかないため、右心系の圧が上昇すると心拍出量に大きな影響を及ぼすことになる。PEEPをかけると静脈灌流は呼吸サイクル中ずっと制限されることになる。正常では肺胞内にかかる圧の約半分がPplに伝わる。一方、病的肺は固いため、それほど多くは伝わらないとされる。右心系のコンプライアンスは高いため、前負荷よりも後負荷の影響を受けやすい。
TPは肺胞内圧とPplの差である。Pplが肺静脈圧を上回ると微小血管が虚脱するためWest Zone 2の状態となる。Pplや間質圧が肺動脈圧よりも高ければ肺血流は閉塞してWest zone 1の状態となる。いずれにしろ、肺胞内圧は右室に対する抵抗になり、後負荷を増加させることになる。
傷害を生じた肺は炎症や虚脱、微小血栓のために血液が流れにくい状態となっており、静水圧の上昇によってガス交換の場に血漿が漏出する。全肺血管抵抗の大部分が微小血管を通過する際に消失するので、ARDSにおいて血流量が増加すると血漿漏出も増加するということになる。さらに、毛細血管そのものの減少によって血管内圧が増加し、心拍出量増加に対する反応も過剰になる。調節換気状態では一回換気とPEEPによってPVRとPplが増加し、肺胞内圧を直接的に増大させるが、これは平均気道内圧で近似される(mPaw)。PEEPはmPawの最大の規定因子ではあるが、mPawは呼吸サイクルが占める割合が大きかったり換気駆動圧が高い場合、すなわち分時換気量が大きい場合も高くなる。平均気道内圧が高いと肺容量が大きくなるだけではなく胸壁も外に向かって押すため、Pplが高くなる。高いmPawにより既に開放されている肺胞をさらに押し広げるため微小血管は閉塞する。ARDS患者ではリクルート可能な肺領域を開放し、すでに広がっている部位はそのまま維持することで肺血管抵抗が改善することになるが、実際は、高いmPawによる正味の作用はWest zone 2を増やすように働き、含気のある部位の肺血管抵抗を高めてその部位の血流を含気のない部位へ誘導してしまい、死腔と右室後負荷を増加してしまう。右室の圧上昇はそのまま左室のコンプライアンスを低下させる。もし心拍出量が変わらないとすれば、左室の低コンプライアンスに対応する形で左房や肺静脈の圧が上昇していることを意味し、これにより肺水腫が形成されやすくなってしまう。右心系の圧上昇はそのまま静脈系の圧上昇をもたらし、輸液負荷の効果を減じ、心拍出量を減らしてしまう。ARDS患者ではmPawが上昇してもPplはさほど大きくはならないが、PVRは大きく上昇する。肺の拡張で胸郭に入る部分で大静脈が圧迫されて静脈灌流が阻害されるとする報告もあるが、この影響は通常小さい。腹腔内圧が選択的に上昇した場合は腹部の血液を胸郭内に押し出すことになるので肺水腫は形成されやすくなる。
◎ 私見
ARDSに限らず、人工呼吸が血行動態にどのように影響を及ぼすのかを正確に理解することは難しい。毎日のようにショック患者の人工呼吸を扱うのだから、この領域は極めて重要なのではないかと思っている。
2016年5月3日火曜日
リバーストリガーをグラフィックモニタで診断する
Does this ventilated patient have asynchronies? Recognizing reverse triggering and entrainment at the bedside.
Murias G, de Haro C, Blanch L.
Intensive Care Med. 2016 Jun;42(6):1058-1061. PMID: 26676866
✔ A) 従量式で換気されている患者の気道内圧と流量、換気量の波形を示してある。吸気開始時に気道内圧の変化がほとんどないため、machine trigger(自発呼吸がなく、設定された時間で自動的に吸気が始まる状態)の状態であるとわかる。一見、全く正常に見えるが、よくみると矢印で示した流量波形はほかの吸気と異なっているように見える。気道内圧波形を見ると吸気時のプラトー部分に陰圧側へのへこみを認める。エアリークがないとすると、呼吸回路内のガス量は一定となり、気道内圧の低下はコンプライアンスの増加を意味することとなる。調節換気中にコンプライアンスの上昇を説明できるのは肺胞のリクルートメントである。自発呼吸のある機械換気中の患者においてはこのコンプライアンスの上昇は吸気努力によって説明される。
Murias G, de Haro C, Blanch L.
Intensive Care Med. 2016 Jun;42(6):1058-1061. PMID: 26676866
✔ Reverse triggering(RT)は受動的肺膨張によって呼吸中枢が刺激されるという非同調の一種で、しばしば見逃されているが、気道内圧と流量波形をみることで診断できる。
 |
| (文献より引用) |
調節換気においてmachine triggerであったとしても、吸気努力の存在を除外できない。呼吸中枢は延髄に存在するが、その律動的な出力(呼吸筋への運動神経出力)は様々な要素によって修飾されている。肺胞換気の増加はPaCO2を減少させ、呼吸中枢を抑制する。機械換気もまた呼吸中枢を刺激する(Entrainment)。PetrilloやGravesらは受動的肺膨張が吸気努力を起こさせることを報告していたが、近年、Akoumianakiらが調節換気中の重症患者に同じような現象が生じることを報告し、RTと名付けた。Entrainmentの最中、調節換気と吸気努力が同じ比率で同調する現象が観察される。通常、そのパターンは短期間しか続かず、7~15回の呼吸サイクルごとに中断される。1:1が最も多いわけではないが、最も安定したパターンであるとはいえる。Gravesらは麻酔状態の人を対象としてEntrainment現象について系統的に調べたところ、呼吸数や一回換気量の変化は様々なリズムの受動的肺膨張と吸気出力の組み合わせをもたらすことを報告している。PaCO2を上昇させたり麻酔レベルを浅くしたりするほど定常状態になりづらくなる。このため、Entrainmentは深鎮静でのみ生じると考えられている。調節換気の開始と自発吸気努力の開始の遅れは全換気時間の中で一定の割合を占めている(Phase angle)。受動的肺膨張だけでなくほかの刺激もEntrainmentを起こすことが分かっている。例えば、呼吸と歩行のリズムのEntrainmentはよく知られている。よって、この気道内圧の低下はリクルートメントかRTかどちらかであるといえる。RTでは吸気努力は調節換気開始から遅れて始まり、調節換気終了後も続く。つまり、調節換気の呼気開始時には吸気筋力がまだ刺激されていることになり、弾性に基づく呼気に抵抗となり、肺胞内圧が上昇し、呼気フローのピークが小さくなる。この図では呼気フローが小さくなっているのでリクルートメントというよりはRTであるといえる。もし十分に深く、かつ長く吸気努力が続けば気道内圧がさらに低下してダブルトリガー(B)をきたす。
C) 従圧式における同様の現象を示してある。肺胞がガスで充満すると肺胞内圧と気道の圧較差が小さくなるので、機械による換気の吸気流量は次第に減少していくパターンとなる。しかしこの図では二峰性の吸気フローを認めている。吸気フローの上昇は肺胞内圧と気道内圧に圧較差が生じたことを示唆するであり、通常はコンプライアンスの改善を示す。呼気開始時のフローが平たん化していることより、コンプライアンスの改善というよりかはRTを示唆する所見である。また、先に示した通り、十分に深く、かつ長く吸気努力が続けばダブルトリガーとなる(D)。
Entrainmentは遅順応性受容体の進展刺激とHering-Breuer反射による持続的迷走神経刺激が原因となって生じる。実際、動物実験において、迷走神経を不活化することでEntrainmentが生じなくなることが示されている。しかし人においては移植肺においても生じることが報告されている。
RTの頻度は不明である。流量や圧波形の微細な変化をみなくてはならないので、特別に注意しないと見逃されてしまう。一般的に呼吸器との非同調は良くない所見だが、RTの意義についてはまだわかっていない。しかし、RTによるダブルトリガーは肺を傷害すると考えられる。RTを理解し、調査する必要がある。
◎ 私見
個人的に興味のあるRTに関する論文。RTはグラフィックモニタを使って診断できるとのこと。自分も波形を見ながら「これはRTだろう」と言ってみたりすることがある。診断するからには何らかの意義が存在しなくてはならないわけだが、それがまだないのがRTの問題。疫学調査をして予後への影響を調査し、治療的介入の効果を測定する必要がある、、、と思われるのだが。
2016年4月30日土曜日
超音波による肺内シャントの検出
An ultrasonographic sign of intrapulmonary shunt.
Mongodi S, Bouhemad B, Iotti GA, Mojoli F.
Intensive Care Med. 2016 May;42(5):912-3.PMID: 26650053
Mongodi S, Bouhemad B, Iotti GA, Mojoli F.
Intensive Care Med. 2016 May;42(5):912-3.PMID: 26650053
✔ 肺エコーは低酸素血症をベッドサイドで診断する際に有用なツールである。組織様所見(Tissue like pattern)が横隔膜上に認められた場合、含気のないconsolidationと定義される。含気のない肺組織が酸素化に与える影響は、低酸素性肺血管収縮や肺内シャントの程度によって決まる。Consolidation内にカラードプラで心拍動に一致する血流のある血管を認める場合、これは肺内シャントである。シャント量を定量することはできないが、このような所見を認めた場合は換気を改善させたり血流を含気のある部位に移動させたりする(つまり、気管支鏡で気道分泌物を取り除いたりリクルートメントを行ったり、腹臥位などの体位変換を行ったりNOを用いる)ことで酸素化を改善することができる。
◎ 私見
肺エコーをする時に時々見られる所見で、前から気になっていた。介入の効果を視覚的に評価できるという利点もありそう。
2016年4月27日水曜日
人工呼吸における吸気から呼気への切り替え
Is the ventilator switching from inspiration to expiration at the right time? Look at waveforms!
Mojoli F, Iotti GA, Arnal JM, Braschi A.
Intensive Care Med. 2016 May;42(5):914-5. PMID: 26690075
Mojoli F, Iotti GA, Arnal JM, Braschi A.
Intensive Care Med. 2016 May;42(5):914-5. PMID: 26690075
✔ 通常の呼吸では吸気から呼気への切り替わりは呼吸筋の完全な弛緩が生じるよりもずっと前に起きる。そのタイミングは呼吸パターンなどによって異なるが、おおむね呼吸筋弛緩開始から完全な弛緩状態となるまでの時間の半分くらいである。人工呼吸における吸気から呼気への切り替わりもこのタイミングに一致することが望ましい。吸気筋によって生じる圧をモニタすることでこのタイミングを評価し、呼吸器の圧波形との関係を示す。
A) 正しいサイクルオフ(吸気から呼気への切り替わり)が行われると、吸気フローの急激な減少からスムーズに呼気へ切り替わってフローのピークを形成し、指数関数的に減速していく波形が得られる。B) サイクルオフが早いと吸気努力の途中で呼気へ切り替わるため呼気波形が変形しピークが平坦になり、同時に気道内圧の落ち込みが見られる。吸気が終了すると通常通りの呼気フローが観察される。C) サイクルオフが遅いと吸気フローの減少が途中から急に遅くなり、自発吸気終了後に受動的膨張が認められる。人工呼吸器に表示される標準的な波形モニタを観察することで、サイクルオフのタイミングを適切に設定することができる。
 |
| サイクルオフのタイミングと波形モニタ(文献より引用) |
◎ 私見
いろいろな医療従事者に出会ってきたが、こういうところをしっかり見ることができるかどうかで人工呼吸に対する親和性を評価できるのではないかと思ったりしている。
2016年4月24日日曜日
ARDSの疫学・治療・予後(LUNG-SAFE study)
Epidemiology, Patterns of Care, and Mortality for Patients With Acute Respiratory Distress Syndrome in Intensive Care Units in 50 Countries.
Bellani G, Laffey JG, Pham T, Fan E, Brochard L, Esteban A, Gattinoni L, van Haren F, Larsson A, McAuley DF, Ranieri M, Rubenfeld G, Thompson BT, Wrigge H, Slutsky AS, Pesenti A; LUNG SAFE Investigators; ESICM Trials Group. Collaborators (843)
JAMA. 2016;315(8):788-800
✔ 背景
ARDSは血管透過性亢進、肺重量増加、含気減少を伴う急性炎症性肺障害である。ベルリン定義に基づいて診断されるが、その疫学、管理内容、予後については調査されていない。ARDS診療においてはいくつかの臨床的疑問がある。すなわち、頻度と重症度、地域差、用いられる治療法(低一回換気量、高PEEP、腹臥位、筋弛緩、VV-ECMOなど)、自然経過などである。
✔ 方法
冬季の任意4週間にICUに入室して陽圧換気をうけた16歳以上の患者を対象とした。毎日「低酸素性呼吸不全」(P/F≦300、新規浸潤影、PEEP/CPAP/EPAP≧5㎝H2O)の発症がないかチェックし、発症した日をDay 1として経過を追った。「ARDS」の診断はベルリン定義にしたがって自動的に行われる。すなわち低酸素性呼吸不全、侵襲より1週間以内、両側浸潤影、心不全の除外である。また、各施設の調査者もARDSを発症したかどうかを問われる。なお、調査者は本研究に参加する前にWebで診断トレーニングを受けた。データ不備、非侵襲的陽圧換気、低酸素性呼吸不全発症から48時間以上経過したものは除外した。
✔ 結果
50か国、459施設が参加。期間中29,144例がICUに入室し、13,566例が人工呼吸管理を受けたが、そのうち、データ不備のない12,906例を解析対象とした。「低酸素性呼吸不全」4,499例のうち3,022例がICU在室中に「ARDS」の診断基準を満たした。「ARDS」発症のタイミングは、Day 1:2,665例、Day 2;148例、Day 3~:209例であった。このうちDay 1・2で「ARDS」を発症し、かつ非侵襲的換気を使用していなかった2,377例を解析した。
「ARDS」は全ICU入室患者の10.4%、人工呼吸管理患者の23.4%でみられた(0.42例/Bed/Month)
。地域差を見てみると、北米:0.46、南米:0.31、アジア:0.27、アフリカ:0.32、オセアニア:0.57であった。「ARDS」の診断基準を満たしたことを調査者が最終的に(入室期間中に)認識できたのは60.2%に過ぎず、タイムリーに認識できたのは34.0%に過ぎなかった。高い看護師/医師-患者比、若年、P/F低値、肺炎、膵炎では「ARDS」を正しく診断できていた。「ARDS」と認識すると、一回換気量は変わらないが高PEEP、腹臥位、筋弛緩薬を多用する傾向があった。
Bellani G, Laffey JG, Pham T, Fan E, Brochard L, Esteban A, Gattinoni L, van Haren F, Larsson A, McAuley DF, Ranieri M, Rubenfeld G, Thompson BT, Wrigge H, Slutsky AS, Pesenti A; LUNG SAFE Investigators; ESICM Trials Group. Collaborators (843)
JAMA. 2016;315(8):788-800
✔ 背景
ARDSは血管透過性亢進、肺重量増加、含気減少を伴う急性炎症性肺障害である。ベルリン定義に基づいて診断されるが、その疫学、管理内容、予後については調査されていない。ARDS診療においてはいくつかの臨床的疑問がある。すなわち、頻度と重症度、地域差、用いられる治療法(低一回換気量、高PEEP、腹臥位、筋弛緩、VV-ECMOなど)、自然経過などである。
✔ 方法
冬季の任意4週間にICUに入室して陽圧換気をうけた16歳以上の患者を対象とした。毎日「低酸素性呼吸不全」(P/F≦300、新規浸潤影、PEEP/CPAP/EPAP≧5㎝H2O)の発症がないかチェックし、発症した日をDay 1として経過を追った。「ARDS」の診断はベルリン定義にしたがって自動的に行われる。すなわち低酸素性呼吸不全、侵襲より1週間以内、両側浸潤影、心不全の除外である。また、各施設の調査者もARDSを発症したかどうかを問われる。なお、調査者は本研究に参加する前にWebで診断トレーニングを受けた。データ不備、非侵襲的陽圧換気、低酸素性呼吸不全発症から48時間以上経過したものは除外した。
✔ 結果
50か国、459施設が参加。期間中29,144例がICUに入室し、13,566例が人工呼吸管理を受けたが、そのうち、データ不備のない12,906例を解析対象とした。「低酸素性呼吸不全」4,499例のうち3,022例がICU在室中に「ARDS」の診断基準を満たした。「ARDS」発症のタイミングは、Day 1:2,665例、Day 2;148例、Day 3~:209例であった。このうちDay 1・2で「ARDS」を発症し、かつ非侵襲的換気を使用していなかった2,377例を解析した。
「ARDS」は全ICU入室患者の10.4%、人工呼吸管理患者の23.4%でみられた(0.42例/Bed/Month)
。地域差を見てみると、北米:0.46、南米:0.31、アジア:0.27、アフリカ:0.32、オセアニア:0.57であった。「ARDS」の診断基準を満たしたことを調査者が最終的に(入室期間中に)認識できたのは60.2%に過ぎず、タイムリーに認識できたのは34.0%に過ぎなかった。高い看護師/医師-患者比、若年、P/F低値、肺炎、膵炎では「ARDS」を正しく診断できていた。「ARDS」と認識すると、一回換気量は変わらないが高PEEP、腹臥位、筋弛緩薬を多用する傾向があった。
「ARDS」の重症度はMild 30.0%、Moderate 46.6%、Severe 23.4%であり、重症度が高くなると補助療法を行う比率と死亡率が高くなっていた。「ARDS」例において、一回換気量が8ml/kgPBWを超えていたものが35.1%、PEEPが12 ㎝H2O未満であったものが82.6%いた。プラトー圧は40.1%で測定されており、重症度があがるにつれてプラトー圧が高くなっていた。肺保護換気設定(一回換気量≦8ml/kgPBW+プラトー圧≦30㎝H2O)は3分の2だけであった。一回換気量はピーク圧、プラトー圧、肺コンプライアンスと関係がなかった。ピーク圧やプラトー圧が高い例でPEEPも高い傾向があった。PEEPはP/F、FIO2、肺コンプライアンスと関係がなく設定されており、FIO2とSpO2に逆相関が認められたことから、低酸素血症に対してはPEEPではなくFIO2で対処していることが分かった。
補助療法ほとんど用いられないが、重症度が高くなると多く使用される傾向があった。「ARDS」のICU死亡率は35.3%、院内死亡率は40.0%であった。重症度があがるほど死亡率が高くなり、人工呼吸管理期間とICU在室日数が長くなるが、在院日数は不変であった。プラトー圧と換気駆動圧が高いほど院内死亡率が高くなった。
✔ 結論
ARDSはICU入室患者の1割に認められるが、見過ごされているうえに治療的介入も不十分であり、死亡率も高い。その管理には改善の余地がある。
補助療法ほとんど用いられないが、重症度が高くなると多く使用される傾向があった。「ARDS」のICU死亡率は35.3%、院内死亡率は40.0%であった。重症度があがるほど死亡率が高くなり、人工呼吸管理期間とICU在室日数が長くなるが、在院日数は不変であった。プラトー圧と換気駆動圧が高いほど院内死亡率が高くなった。
✔ 結論
ARDSはICU入室患者の1割に認められるが、見過ごされているうえに治療的介入も不十分であり、死亡率も高い。その管理には改善の余地がある。
◎ 私見
当施設も参加したLUNG-SAFE研究。同じ月にSepsis-3が発表されていて、なんとなく影が薄いけど、かなり重要な意味があるのではないかと思っている。意外とPEEPは低いし、一回換気量は制限できていないことがわかった。日頃から悩んでいること(一回換気量の制御など)が、他の施設でも同じような傾向になっていて面白い。一回換気量の制御~換気駆動圧の制御をどのようにモニターしてどのように行うのか、が今後の課題だろう。
2016年4月21日木曜日
イオン化カルシウム③
Ionized Calcium in the ICU: Should It Be Measured and Corrected?
Aberegg SK.
Chest. 2016 Mar;149(3):846-55. PMID: 26836894
Aberegg SK.
Chest. 2016 Mar;149(3):846-55. PMID: 26836894
イオン化カルシウムに関するReview。
✔ カルシウム補正の理論的背景
ICU以外の状況においては、重篤な低イオン化カルシウム血症は凝固障害、心原性ショック、うっ血性心不全、房室ブロック、けいれん、喉頭痙攣などと関連して報告されている。しかし、これらの報告は慢性的な、もしくは重篤なカルシウムホメオスタシス異常の存在に基づくものであることに注意が必要である。より程度の軽い敗血症などにみられる低カルシウム血症に一般化すべきではない。
ルーチンの測定と補正が正当化されるには、低カルシウム血症が死亡率上昇や予後悪化の原因であることを示す必要がある。しかし、現状では因果関係は明らかではない。低カルシウム血症は重症患者における適応反応のひとつであるとする意見もあるが、よくわかっていない。これが本当なら、より重篤な患者ではより強い適応反応が起きることを反映してカルシウムがより低下することになる。入院患者のカルシウム値の分布は健常者とほぼ一緒だが平均値は低い。つまり、重症患者でみられる低カルシウム血症は”Sick eucalcemia syndrome”とでもいうべきものである(Sick euthyroid syndromeと同様に)。要約すると、まだ証明されているわけではないがあり得る仮説としては、健常者と患者ではイオン化カルシウムのホメオスタシスのセットポイントが変化するということである。
カルシウムを補正する行為は、正常値への固執、過剰な異常値への恐怖を示しているにすぎないように見える。もし、カルシウムが低値になることが正常な適応反応であるとすると、カルシウムの補正は有害である可能性もあるのである。似たような正常値への固執の有害性を示す例としては、ヘモグロビンと輸血、血糖値、発熱などが挙げられる。
さらに、カルシウム投与が有害であることを示す報告もある。Collageらは敗血症マウスにカルシウムを投与すると炎症を悪化させ、血漿漏出を増やし、死亡率を上昇させることを示している。また、ICU患者を対象とした後ろ向きコホート研究でもカルシウムを投与された患者の死亡率が高いことが報告されている。また、頻回の採血に伴う貧血や投与に伴う静脈炎といった問題もある。
✔ 特殊な状況
低マグネシウム血症は低カルシウム血症の原因となり、補正に抵抗性となるため、低栄養、アミノグリコシド投与、化学療法、PPI投与中は注意が必要である。多くの観察研究では輸血を擁した患者を除外しているが、赤血球輸血におけるキレート剤の影響を除外するためである。大量輸血に伴う低カルシウム血症への対応はよくわかっていないが、この場合は補正するほうが良いとする意見が多い。周術期におけるカルシウム補正についてもよく分かっていない。
◎ 私見
カルシウムが敗血症モデルマウスの死亡率を上昇させることは知らなかった。勉強不足。低血圧+低カルシウム血症で輸液や昇圧剤などを組み合わせてもうまくいかないときは低カルシウム血症を補正するとよいと考えていたのだが、一から考え直さなくてはならないようだ。
✔ カルシウム補正の理論的背景
ICU以外の状況においては、重篤な低イオン化カルシウム血症は凝固障害、心原性ショック、うっ血性心不全、房室ブロック、けいれん、喉頭痙攣などと関連して報告されている。しかし、これらの報告は慢性的な、もしくは重篤なカルシウムホメオスタシス異常の存在に基づくものであることに注意が必要である。より程度の軽い敗血症などにみられる低カルシウム血症に一般化すべきではない。
ルーチンの測定と補正が正当化されるには、低カルシウム血症が死亡率上昇や予後悪化の原因であることを示す必要がある。しかし、現状では因果関係は明らかではない。低カルシウム血症は重症患者における適応反応のひとつであるとする意見もあるが、よくわかっていない。これが本当なら、より重篤な患者ではより強い適応反応が起きることを反映してカルシウムがより低下することになる。入院患者のカルシウム値の分布は健常者とほぼ一緒だが平均値は低い。つまり、重症患者でみられる低カルシウム血症は”Sick eucalcemia syndrome”とでもいうべきものである(Sick euthyroid syndromeと同様に)。要約すると、まだ証明されているわけではないがあり得る仮説としては、健常者と患者ではイオン化カルシウムのホメオスタシスのセットポイントが変化するということである。
カルシウムを補正する行為は、正常値への固執、過剰な異常値への恐怖を示しているにすぎないように見える。もし、カルシウムが低値になることが正常な適応反応であるとすると、カルシウムの補正は有害である可能性もあるのである。似たような正常値への固執の有害性を示す例としては、ヘモグロビンと輸血、血糖値、発熱などが挙げられる。
さらに、カルシウム投与が有害であることを示す報告もある。Collageらは敗血症マウスにカルシウムを投与すると炎症を悪化させ、血漿漏出を増やし、死亡率を上昇させることを示している。また、ICU患者を対象とした後ろ向きコホート研究でもカルシウムを投与された患者の死亡率が高いことが報告されている。また、頻回の採血に伴う貧血や投与に伴う静脈炎といった問題もある。
✔ 特殊な状況
低マグネシウム血症は低カルシウム血症の原因となり、補正に抵抗性となるため、低栄養、アミノグリコシド投与、化学療法、PPI投与中は注意が必要である。多くの観察研究では輸血を擁した患者を除外しているが、赤血球輸血におけるキレート剤の影響を除外するためである。大量輸血に伴う低カルシウム血症への対応はよくわかっていないが、この場合は補正するほうが良いとする意見が多い。周術期におけるカルシウム補正についてもよく分かっていない。
◎ 私見
カルシウムが敗血症モデルマウスの死亡率を上昇させることは知らなかった。勉強不足。低血圧+低カルシウム血症で輸液や昇圧剤などを組み合わせてもうまくいかないときは低カルシウム血症を補正するとよいと考えていたのだが、一から考え直さなくてはならないようだ。
2016年4月18日月曜日
イオン化カルシウム②
Ionized Calcium in the ICU: Should It Be Measured and Corrected?
Aberegg SK.
Chest. 2016 Mar;149(3):846-55. PMID: 26836894
Aberegg SK.
Chest. 2016 Mar;149(3):846-55. PMID: 26836894
イオン化カルシウムに関するReview。
✔ 現状
イオン化カルシウムの正常範囲は施設や研究によってばらばらであり、異常値をどのように定義するかもばらばらである。このような状況では約50%で一度は異常値を呈するといわれるICU患者のカルシウム異常の疫学を知ることはできない。
多くの施設で積極的にカルシウムは測定され、低カルシウム血症は補正されている。この”ホメオスタシス維持”のアプローチは原因を特定して治療するというより値を正常範囲にすることを主目的としていることがいくつかの研究から読み取れる。さらに、ICUにおけるカルシウム投与は値を正常範囲にすることだけが目的であり症状を改善させることを目的としていないという問題も指摘できる。
このような状況では重症患者においてカルシウムをルーチンに計測して補正することを正当化することはできない。Cochrane ReviewによるとICUにおけるカルシウム投与の死亡率・臓器不全・在室日数・コスト・合併症をアウトカムとした比較試験をひとつも見出すことができなかった。以下の章では、どのようなデータに基づいて現在のような臨床が行われるようになってきたのかをみていく。
✔ 観察研究
1980年代初頭より、重症患者では低カルシウム血症を呈するような疾患、例えば副甲状腺機能低下症やビタミンD欠損症が極めてまれであるにもかかわらず、イオン化カルシウム濃度が低いことが報告されるようになっている。さらに、低カルシウム血症が死亡の危険因子であることも報告されている。一方で、APACHEⅡスコアに代表されるような重症度とも強く挿管することが知られており、多変量解析を用いると死亡予測に対するカルシウムの有意性は消失することも報告されている。通常、1週間で正常になるが、死亡群は生存群ほど早く正常にならないというカルシウム濃度の変化に関する研究もみられる。
低カルシウム血症に対するカルシウム投与については4つの観察研究がある。頻回に検査され、約50%で低カルシウム血症が見つかり、大量のカルシウム製剤が消費されている。興味深いのは、カルシウムを投与してもイオン化カルシウム濃度はわずかにしか改善しないということである。標準検査項目からイオン化カルシウムを除くことで(つまりルーチンにしないことで)イオン化カルシウム検査数が75%減少し、カルシウム投与量も減少したという報告もある。これによって死亡や心停止が増えた証拠はなく、痙攣はむしろ減ったとしている。これらの研究からは、イオン化カルシウムを測定してカルシウムを投与しても、そもそも値をほとんど改善させることができず、アウトカムも変えないということが言えそうである。
◎ 私見
カルシウムの投与に関しては質の高い研究はなく、観察研究でも特別有用とは言えないということであった。カルシウムは昇圧剤であるとイメージして使用しているが、これにも意味はないのだろうか。低カルシウム血症の程度の問題もあるし、もうすこし研究がされてもいい分野なのではないかという気がする。
イオン化カルシウムの正常範囲は施設や研究によってばらばらであり、異常値をどのように定義するかもばらばらである。このような状況では約50%で一度は異常値を呈するといわれるICU患者のカルシウム異常の疫学を知ることはできない。
多くの施設で積極的にカルシウムは測定され、低カルシウム血症は補正されている。この”ホメオスタシス維持”のアプローチは原因を特定して治療するというより値を正常範囲にすることを主目的としていることがいくつかの研究から読み取れる。さらに、ICUにおけるカルシウム投与は値を正常範囲にすることだけが目的であり症状を改善させることを目的としていないという問題も指摘できる。
このような状況では重症患者においてカルシウムをルーチンに計測して補正することを正当化することはできない。Cochrane ReviewによるとICUにおけるカルシウム投与の死亡率・臓器不全・在室日数・コスト・合併症をアウトカムとした比較試験をひとつも見出すことができなかった。以下の章では、どのようなデータに基づいて現在のような臨床が行われるようになってきたのかをみていく。
✔ 観察研究
1980年代初頭より、重症患者では低カルシウム血症を呈するような疾患、例えば副甲状腺機能低下症やビタミンD欠損症が極めてまれであるにもかかわらず、イオン化カルシウム濃度が低いことが報告されるようになっている。さらに、低カルシウム血症が死亡の危険因子であることも報告されている。一方で、APACHEⅡスコアに代表されるような重症度とも強く挿管することが知られており、多変量解析を用いると死亡予測に対するカルシウムの有意性は消失することも報告されている。通常、1週間で正常になるが、死亡群は生存群ほど早く正常にならないというカルシウム濃度の変化に関する研究もみられる。
低カルシウム血症に対するカルシウム投与については4つの観察研究がある。頻回に検査され、約50%で低カルシウム血症が見つかり、大量のカルシウム製剤が消費されている。興味深いのは、カルシウムを投与してもイオン化カルシウム濃度はわずかにしか改善しないということである。標準検査項目からイオン化カルシウムを除くことで(つまりルーチンにしないことで)イオン化カルシウム検査数が75%減少し、カルシウム投与量も減少したという報告もある。これによって死亡や心停止が増えた証拠はなく、痙攣はむしろ減ったとしている。これらの研究からは、イオン化カルシウムを測定してカルシウムを投与しても、そもそも値をほとんど改善させることができず、アウトカムも変えないということが言えそうである。
◎ 私見
カルシウムの投与に関しては質の高い研究はなく、観察研究でも特別有用とは言えないということであった。カルシウムは昇圧剤であるとイメージして使用しているが、これにも意味はないのだろうか。低カルシウム血症の程度の問題もあるし、もうすこし研究がされてもいい分野なのではないかという気がする。
2016年4月14日木曜日
イオン化カルシウム①
Ionized Calcium in the ICU: Should It Be Measured and Corrected?
Aberegg SK.
Chest. 2016 Mar;149(3):846-55. PMID: 26836894
Aberegg SK.
Chest. 2016 Mar;149(3):846-55. PMID: 26836894
✔ カルシウムの生理
カルシウムは神経伝達や筋収縮、凝固系などで重要な役割を担っている。生体のカルシウムの99%が骨に存在し、残りは細胞外にあり、細胞内にはほとんどない。細胞外カルシウムの量は厳密にコントロールされており、血清検体で計測することができるが、およそ半分は陰性に荷電したアルブミンなどに結合して存在しており、残り半分がイオン化カルシウムとして存在している。このイオン化カルシウムが生理活性を持っており、アルブミン濃度や酸塩基平衡の状態に影響されないためICUでよく計測される。カルシウムのホメオスタシスは副甲状腺ホルモン、ビタミンD、影響は少ないがカルシトニンによって調整されている。摂取量の減少、血管内でのキレート化、細胞外への沈着によってバランスは崩れる。バランスが崩れるとテタニー、筋力低下、不整脈、けいれんなどの症状が出現する。
✔ ICUにおけるイオン化カルシウムの異常
腎不全や低マグネシウム血症を除けば、カルシウムのホメオスタシスに影響する疾患は一般的にはまれであり、通常テタニーや筋力低下といった症状があったり、副甲状腺手術後、骨粗鬆症、シスプラチンのようなカルシウムの異常を容易に予測できる臨床状況であったりするため、カルシウムの異常の存在を想起することは難しくない。それゆえ、特殊な臨床状況によってカルシウム異常の検査前確率が高まったときのみカルシウムを測定することになると考えられている。反対にICUではイオン化カルシウムの異常は頻繁にみられるが、カルシウムのホメオスタシスに影響するような背景疾患があるということはほとんどない。また、ICUでは無症状であったり鎮静などの影響でマスクされたり、他の疾患の影響を受けたりするため、低カルシウム血症の症状が議論になることはほとんどない。つまり、ICUにおいてはイオン化カルシウムをルーチンに計測することは診断的検査の原則に沿うとは思われない。ICUではむしろスクリーニングや恒常性の維持、異常の検出のために計測されている。このような目的で行われる検査は、イオン化カルシウムの異常を検出して治療的介入を行うことが患者の利益になる場合によってのみ正当化される。本論文では①ICUでイオン化カルシウムを計測すべきか? ②異常値を補正すべきか? という2点について述べる。なお、本論文では低カルシウム血症について特に述べる。
◎ 私見
イオン化カルシウムは血液ガス検査装置でルーチンに表示されるようになっている。血行動態が悪かったり凝固機能に不安がある状況では補正してしまっていたが、それが本当に正しいことなのかどうかを考えたことはなかったのでこの論文を読んでみた。その行為に本当に意味があるのか、という視点は確かに重要。でも、根拠に縛られすぎても身動きできなくなってしまうのではないかと思ったりする。
2016年4月11日月曜日
ARDSをどのように治療するか
How ARDS should be treated.
Gattinoni L, Quintel M.
Crit Care. 2016 Apr 6;20(1):86. PMID: 27048605
Gattinoni L, Quintel M.
Crit Care. 2016 Apr 6;20(1):86. PMID: 27048605
✔ 様々な病因で肺実質に炎症がおきるが、時にその炎症が肺全体に広がってびまん性の肺水腫をきたすことがあり、これをARDSという。肺重量が増加するに従い、下側の肺は虚脱し、上側の肺は歓喜によって開放され続けるようになる。換気のない領域が生じて、肺容量が小さくなるため、ARDSのふたつの主要な症状が引き起こされる。すなわち、酸素投与に抵抗性の低酸素血症と肺コンプライアンスの低下である。
ARDSではその原因となった疾患を治療しなくてはならない。病態生理を参考に、ステロイド、スタチン、抗メディエータ薬が試されたが、明らかに予後を改善するものはない。一方でガス交換に対する治療は原因疾患とは関係がなく、非特異的である。なぜなら、その治療目標や治療合併症は浮腫の程度によるからである。
したがって、ARDSに対しては、まず特異的な治療の対象となりうる原因疾患を特定し、ARDSの重症度を判定するという二つのステップから始まることになる。重症度を評価するために、CTやそのほかの画像検査を用いて浮腫の量を測ったり、肺外水分量を測定したりする。ベルリン分類はPEEP5㎝H2Oをかけた状態で行うが、浮腫や肺のリクルート可能領域を評価するうえで有用であるため推奨できる。
人工呼吸管理をのものはARDSを治癒させないが、生存に必要なガス交換を維持して時間を稼ぐことができる。これは呼吸筋の機能を肩代わりすることで得られる利益である。ARDSでは呼吸筋はいくつかの理由により換気に十分なパワーを供給することができなくなっている。人工呼吸管理の酸素化に与える影響はふたつある。すなわち、FIO2を厳密に調整できるということと、吸気時に虚脱した肺領域を開放するのに十分な圧を供給してこの領域を灌流する血液を酸素化することである。しかし、PEEPが十分でないと呼気時にこの肺領域は再度虚脱してしまう。PEEPが十分でないと、一回換気が酸素化に与える影響は限定的となる。一方で換気は炭酸ガスの排出に必要である。ARDSでは呼吸仕事量の増大と死腔の増大のため、正常より多い分時換気量が必要となるが、ある程度の高炭酸ガス血症は許容してよい。Baby lungという考え方は応力(換気駆動圧)とひずみ(一回換気量)が残存肺領域にとって過剰であることを意味している。これはARDSの重症度が高くなるほど問題となる。したがって、酸素化を改善しようとする時よりも換気を改善しようとする時に人工呼吸に関連する危険性が生じることになる。実際、ARDSの重症度が高くなると人工呼吸に伴う応力によって肺の細胞外組織にさらなる炎症が引き起こされることが示されている。
人工呼吸管理に伴う損傷はVentilator-induced lung injury(VILI)と言われるが、自発呼吸時にも生じる可能性があるため、正確にはVentilation-induced lung injuryというべきである。VILIは一回換気量、換気駆動圧、呼吸数、ガス流量が過剰な時に起きる。肺に過剰な力(単位時間あたりに肺に加えられるエネルギー)が過剰な時にVILIが起きると考えられる。ここで、過剰とはBaby lungにとって過剰であるという意味である。また、Meadらが指摘したように、不均一な肺に力が加わると、ある局所では加えられるエネルギーが何倍にも大きくなる。
したがって、ARDSの呼吸療法においては加えられる機械的力をできる限り小さくすべきであると考える。機械的力は一回換気量、換気駆動圧、呼吸数の総和である。なお、PEEPは換気量の変化を生み出さないのでエネルギー負荷をもたらさない。一回換気量、換気駆動圧、呼吸数を減らすアプローチはVILIを減らす。HFOが失敗に終わったのも、換気駆動圧と非常に大きい呼吸数によってもたらされる機械的負荷によって説明できる。機械的負荷が一定の時、肺がより均一で応力が大きくなるような要因がなければVILIのリスクは減る。そのためには適切なレベルのPEEPと腹臥位が有用である。PEEPは均一性を増加させ、肺領域を開放したままにできる。腹臥位も解剖学的に生じる重力の影響に拮抗することで肺の均一性を改善することができる。PEEPも腹臥位も中等度から重度のARDSでリクルートされる肺領域が大きい症例にのみ有効性が示されている。
◎ 私見
Gattiononi先生のARDS治療に関する概説。原因を特定して治療すること、陽圧換気による負荷をできるだけ(特に重症度の高いARDSであればあるほど)減らすことを強調している。ここでは触れられていないが、筋弛緩薬も関係してくるだろう。鎮痛薬や鎮静薬も見直されていくのかもしれない。今後は、いくつかの評価方法(EITや食道内圧を含む)と介入方法(PEEPや腹臥位、VVECMOなど)をどう組み合わせていくのが最も有用なのかが検証されていくのだろうか。
人工呼吸管理に伴う損傷はVentilator-induced lung injury(VILI)と言われるが、自発呼吸時にも生じる可能性があるため、正確にはVentilation-induced lung injuryというべきである。VILIは一回換気量、換気駆動圧、呼吸数、ガス流量が過剰な時に起きる。肺に過剰な力(単位時間あたりに肺に加えられるエネルギー)が過剰な時にVILIが起きると考えられる。ここで、過剰とはBaby lungにとって過剰であるという意味である。また、Meadらが指摘したように、不均一な肺に力が加わると、ある局所では加えられるエネルギーが何倍にも大きくなる。
したがって、ARDSの呼吸療法においては加えられる機械的力をできる限り小さくすべきであると考える。機械的力は一回換気量、換気駆動圧、呼吸数の総和である。なお、PEEPは換気量の変化を生み出さないのでエネルギー負荷をもたらさない。一回換気量、換気駆動圧、呼吸数を減らすアプローチはVILIを減らす。HFOが失敗に終わったのも、換気駆動圧と非常に大きい呼吸数によってもたらされる機械的負荷によって説明できる。機械的負荷が一定の時、肺がより均一で応力が大きくなるような要因がなければVILIのリスクは減る。そのためには適切なレベルのPEEPと腹臥位が有用である。PEEPは均一性を増加させ、肺領域を開放したままにできる。腹臥位も解剖学的に生じる重力の影響に拮抗することで肺の均一性を改善することができる。PEEPも腹臥位も中等度から重度のARDSでリクルートされる肺領域が大きい症例にのみ有効性が示されている。
◎ 私見
Gattiononi先生のARDS治療に関する概説。原因を特定して治療すること、陽圧換気による負荷をできるだけ(特に重症度の高いARDSであればあるほど)減らすことを強調している。ここでは触れられていないが、筋弛緩薬も関係してくるだろう。鎮痛薬や鎮静薬も見直されていくのかもしれない。今後は、いくつかの評価方法(EITや食道内圧を含む)と介入方法(PEEPや腹臥位、VVECMOなど)をどう組み合わせていくのが最も有用なのかが検証されていくのだろうか。
2016年4月8日金曜日
心停止に対する抗不整脈の効果
Amiodarone, Lidocaine, or Placebo in Out-of-Hospital Cardiac Arrest
Peter J. Kudenchuk, M.D., et al Resuscitation Outcomes Consortium Investigators*
April 4, 2016DOI: 10.1056/NEJMoa1514204
Peter J. Kudenchuk, M.D., et al Resuscitation Outcomes Consortium Investigators*
April 4, 2016DOI: 10.1056/NEJMoa1514204
✔ 背景
院外心停止における除細動に反応しない心室細動ならびに心室頻拍に対し、抗不整脈がよく用いられるが、生存率を改善させるかどうかまではわかっていない。
✔ 方法
北米で行われた前向き無作為化試験。心室細動もしくは無脈性心室頻拍で少なくとも1回の除細動に反応せず、静脈ラインが確保されている成人を対象としてアミオダロン、リドカイン、プラセボ(生理食塩水)を無作為に投与した。プライマリアウトカムは生存退院率とした。セカンダリアウトカムは退院時の神経学的予後とした。
✔ 結果
Per-protocol analysisで解析した。3026例がアミオダロン(974)、リドカイン(993)、プラセボ(1059)に無作為に振り分けられた。それぞれ、24.4%、23.7%、21.0%が生存退院した。アミオダロン vs プラセボの生存率の差は3.2%(-0.4~7.0、p=0.08)、アミオダロン vs リドカインは0.7%(-3.2~4.7、p=0.70)であった。退院時の神経学的予後は三群間で差がなかった。心停止の目撃がある場合とない場合とでは治療の効果に差があった。プラセボではなく薬剤が投与された場合、目撃のある心停止では有意に生存退院率が高くなったが、目撃がない心停止の場合では有効ではなかった。アミオダロンを投与された群では蘇生後に一時ペーシングを要する患者が多かった。
✔ 結論
除細動抵抗性の初期波形が心室細動ないし心室頻拍の院外心停止において、アミオダロンもリドカインも生存退院率や神経学的予後を改善しなかった。
◎ 私見
心停止における抗不整脈薬の有用性に関する研究。ITT解析ではないとか、目撃のあるなしが均一ではないとか問題はあるものの、かなりインパクトのある結果ではある。目撃のある=心肺停止からの時間が短く、かつ除細動抵抗性があるものに関しては抗不整脈が良い可能性は残されている。心室細動発生からの時間が短いほど除細動成功率は高まるはずなのに除細動に抵抗するような、いわゆるElectrical stormでは抗不整脈が有用ということなのかもしれない。逆に、心停止発症からの時間が比較的長い場合、不整脈を止める・止めないということよりもCPRの質であったり、もともとの病態などが大きく影響してくるということだろう。しかし、この領域でRCTができるなんて、驚きである。
2016年4月5日火曜日
蘇生後のショックにステロイドは無効
Corticosteroid therapy in refractory shock following cardiac arrest: a randomized, double-blind, placebo-controlled, trial.
Donnino MW, Andersen LW, Berg KM, Chase M, Sherwin R, Smithline H, Carney E, Ngo L, Patel PV, Liu X, Cutlip D, Zimetbaum P, Cocchi MN; collaborating authors from the Beth Israel Deaconess Medical Center’s Center for Resuscitation Science Research Group.
Crit Care. 2016 Apr 3;20(1):82.PMID: 27038920
Donnino MW, Andersen LW, Berg KM, Chase M, Sherwin R, Smithline H, Carney E, Ngo L, Patel PV, Liu X, Cutlip D, Zimetbaum P, Cocchi MN; collaborating authors from the Beth Israel Deaconess Medical Center’s Center for Resuscitation Science Research Group.
Crit Care. 2016 Apr 3;20(1):82.PMID: 27038920
✔ 背景
心肺停止蘇生後には支持療法と体温コントロール以外には有効な治療は知られていない。副腎不全は重症患者や心肺停止蘇生後に認められることがあり、予後を悪化させる。議論のあるところであるが、敗血症性ショックで治療に反応しないショックを呈する患者ではステロイドを投与することでショックの離脱を促進し、予後を改善させる可能性がある。心肺停止蘇生後の遷延するショックに対してステロイドが有効かどうかを検証した。
✔ 方法
多施設前向き無作為化試験。18歳以上の院内・院外心肺停止蘇生後で、1時間以上血管作動薬を必要とした患者を対象とした。血管作動薬依存性の定義は、ノルアドレナリン、ドパミン、バゾプレシンを使用しているものとし、ドブタミンや他の昇圧剤は対象としなかった。Hydrocorticortisone 100㎎を8時間ごとに投与するか、プラセボを投与した。ショック離脱までの時間をプライマリアウトカムとした。また、試験薬剤投与前にCosyntropin刺激試験を行い、試験薬剤初回投与から24時間後のIL6とIL10を測定した。
✔ 結果
各群25例ずつが対象となった。ショック離脱までの時間に有意差はなかった。ショック離脱の有無、神経学的予後、生存退院率にも差がなかった。もともとのコルチゾル値が15μg/dL未満であった例(ステロイド群6人、プラセボ群3人)に限ってみたところ、ステロイド群は全例ショックから離脱したがプラセボ群は1例しか離脱しなかった。また、ステロイド群のうち3人は生存したが、プラセボ群は全例が最終的に死亡した。24時間後のIL10に差はなかったが、IL6はステロイド群で優位に低くなった。
✔ 結論
血管作動薬に依存する心肺停止蘇生後のショック例ではステロイドの投与が予後を改善するという証拠はなかった。
◎ 私見
心肺停止蘇生後症候群にステロイドは無効。副腎機能が真に低下している患者ではもしかしたら有用かもしれないが、数が少なすぎて確定的なことは何も言えない。今後、追試されることになるだろうか? 病態から考えると、全く無効というのも信じがたいのだけど…
登録:
投稿 (Atom)